
| A.Fe3O4 | B.MnO2 | C.Cr2O3 | D.V2O5 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:不详 题型:单选题

| A.图①表示可逆反应CO(g)+H2O(g)═CO2(g)+H2(g)中的△H小于0 |
| B.图②为电解硫酸铜溶液的装置,一定时间内两电极产生单质的物质的量之比一定为1:1 |
| C.图③表示测定某溶液pH的实验操作 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.MnO2是氧化剂,被氧化 |
| B.碳棒为负极、锌筒为正极 |
| C.放电过程中NH4+向锌极移动 |
| D.负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
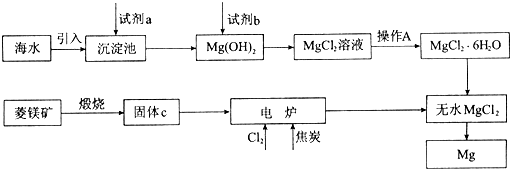
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.炼铁时,还原剂CO将铁从矿中还原出来 |
| B.活泼金属Na只能用电解法冶炼 |
| C.汞的冶炼只能用还原剂法 |
| D.铝的冶炼可用还原法来冶炼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
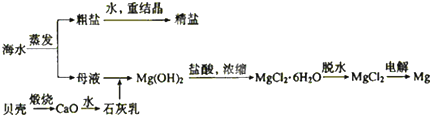
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业提取镁是将海水中的镁转化为氯化镁再电解得到单质镁 |
| B.工业提取铝是把铝土矿中的氧化铝提纯后采用加热分解法制备单质铝 |
| C.工业采用高炉法炼铁 |
| D.工业采用接触法制造浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.电路中通过电子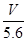 mol mol | B.n= |
C.溶液中H+增加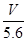 mol mol | D.n=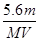 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –-6e–+ 3H2O = IO3 – + 6H+ |
| C.在KI溶液溶液中加入酚酞,电解时阳极区变红色 |
| D.电解时溶液中I –向阴极迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com