
【题目】下列有关颜色的变化不能用勒夏特列原理解释的是( )
A.平衡状态的H2、I2、HI混合气体体积压缩时颜色变深
B.平衡状态的NO2和N2O4混合气体体积压缩时颜色先变深后变浅
C.平衡状态的NO2、CO、NO、CO2混合气体升温时颜色变深
D.向Fe(SCN)3溶液中滴加几滴浓KSCN溶液后颜色变深
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不能用H++OH-=H2O表示的是( )
A. 硫酸氢钠和氢氧化钡 B. 氢氧化钾和盐酸
C. 硝酸和氢氧化钠 D. 氢氧化钡和硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是
A. 铁片与过量浓硝酸(常温) B. 铜粉与过量浓硝酸(常温)
C. 浓盐酸与过量MnO2(共热) D. 浓硫酸与过量铜片(共热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是电动汽车首选的电池之一,该电池的工作原理为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,
3Zn(OH)2+2Fe(OH)3+4KOH,
下列关于该电池放电时的说法中正确的是( )
A.高铁电池产生的电流从负极经外电路到达正极
B.正极反应式为Zn+2OH--2e - =Zn(OH)2
C.负极pH减小,正极pH增大,电解液pH增大
D.每氧化1mol高铁酸钾转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.焓变和熵变都大于0的反应肯定是自发的
B.焓变小于0而熵变大于0的反应肯定是自发的
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
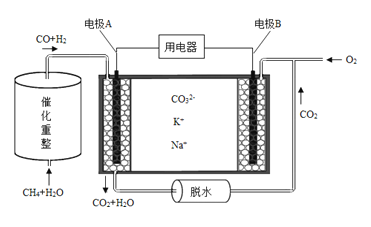
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 组成细胞的元素和细胞中的无机盐均主要以离子的形式存在
B. 组成麦芽糖、乳糖、纤维素、糖原的单体都是葡萄糖
C. 有些蛋白质起信息传递作用,能够调节机体的生命活动,如胰岛素、雄性激素的
D. 核酸、磷脂都含有C、H、O、P、N、P
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com