
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ��c������������Ϊ���ڲ��������3����b3-��C2-��������Ų���ͬ�� d��cͬ�壻e�������ֻ��1�����ӣ������ȫ����������˵���������
A. a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪsp3
B. b��c��d�е縺��������d
C. e�ļ۲�����Ų�ͼΪ![]()
D. ��5��Ԫ���γɵ�һ��1:1�����ӻ������У������ӳ�������ṹ���þ���ṹ�е������������Ӽ������Լ�����λ��
���𰸡�B
�����������ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e,ԭ��������������,a�ĺ����������������������ͬ,��a��HԪ����c������������Ϊ���ڲ��������3��,ԭ��ֻ����2�����Ӳ�,����������Ϊ6,��c��OԪ����d��cͬ��,��d��SԪ����b3-��c2-��������Ų���ͬ������bΪNԪ����e�������ֻ��1�����ӣ������ȫ������ֻ�ܴ��ڵ�������,���������Ϊ2+8+18+1=29,ΪCuԪ������ԭ���뵪ԭ���γɰ�����������ԭ������sp3�ӻ������ӳ������Σ�A��ȷ��b��c��d�ֱ�ΪN��O��S��ͬһ���ڣ������ң��縺������ͬһ���壬���ϵ��£��縺����С���������Ԫ���е縺��������c��B������eΪͭԪ�����˵����Ϊ29����������Ų�Ϊ1s22s22p63s23p63d104s1���۲�����Ų�ͼΪ![]() ��C��ȷ����5��Ԫ���γɵ�һ��1:1�����ӻ�������,�����ӳ�������ṹ,˵���������Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷ�,ӦΪSO42-����ѧʽΪ
��C��ȷ����5��Ԫ���γɵ�һ��1:1�����ӻ�������,�����ӳ�������ṹ,˵���������Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷ�,ӦΪSO42-����ѧʽΪ![]() ,�þ���ṹ�е������������Ӽ������Լ�����λ���� D��ȷ����ȷѡ��B��
,�þ���ṹ�е������������Ӽ������Լ�����λ���� D��ȷ����ȷѡ��B��


 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ���ԭ�����Դ������Ṥҵ������SO2β�����ֽ�SO2 ͨ����ͼװ��(�缫��Ϊ���Բ���)����ʵ�顣����˵������ȷ����
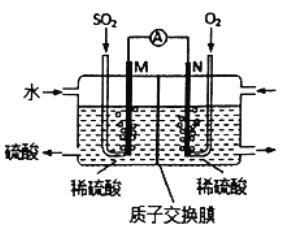
A. M��Ϊ�������缫�Ϸ���������Ӧ
B. ��Һ��H+����N����SO42-����M��
C. N�������ĵ缫��ӦΪO2+4H++4e-=2H2O
D. ��ͬ�����£�M��N���������ĵ��������֮��Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѡ�������������ͭ�Ƚ������仯�����ڹ�ҵ������Ҫ��;��
��1�������Ͻ�����ϵ����Ͻ�Ĵ������úϽ���з����¶ȵ͡��۸����е��ŵ㡣
��Ti�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ______________��
��Fe�Ļ�̬ԭ�ӹ���_________�ֲ�ͬ�ܼ��ĵ��ӡ�
��2���Ʊ�CrO2Cl2�ķ�ӦΪK2Cr2O7+3CCl4�T2KCl+2CrO2Cl2+3COCl2����
��������ѧ����ʽ�зǽ���Ԫ�ص縺���ɴ�С��˳����_____����Ԫ�ط��ű�ʾ����
��COCl2����������ԭ�Ӿ�����8���ӹ��ͣ�COCl2�����ЦҼ��ͦм��ĸ�����Ϊ_____������ԭ�ӵ��ӻ���ʽΪ_____________��
��3��NiO��FeO�ľ���ṹ�����Ȼ��Ƶľ���ṹ��ͬ������Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ6.9��10��2 nm��7.8��10��2 nm�����۵㣺NiO________�����������������=����FeO��
��4��Ni��La�ĺϽ���Ŀǰʹ�ù㷺�Ĵ�����ϣ����д����������������͵��µ��ص㣬���ձ����й���ʵ���˲�ҵ�����úϽ�ľ����ṹ��ͼ��ʾ��
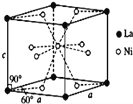
�ٸþ���Ļ�ѧʽΪ_____________��
����֪�þ�����Ħ������ΪM gmol��1���ܶ�Ϊd gcm��3����NAΪ�����ӵ�������ֵ����þ����������_____ ���ú�M��d��NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�м��������������ʣ��ܴٽ�ˮ�������
A. ��ˮB. ������C. ��������D. ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ɫ���д̼�����ζ���ǣ���
A. N2 B. Cl2 C. SO2 D. NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ڹ輰�仯����������У�����ȷ���ǣ� ��
A.����������ڲ����ϵ�̻���
B.�������մɡ�ˮ����ڴ�ͳ�Ĺ����β�Ʒ
C.�轺������ʳƷ�����
D.��Ԫ�ػ�ѧ���ʲ����ã�����Ȼ���п�������̬��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��W��X��Y��Z��ԭ�������������ӡ�p��q��r������ЩԪ����ɵĶ�Ԫ�����m��n�ֱ���Ԫ��Y��Z�ĵ��ʣ�nͨ��Ϊ�����ɫҺ�壬0.01mol/L r��Һ��pHΪ2��p��Ӣ����ѧ�ҷ����ڳ�Ϊ�������̼�������sͨ����������ˮ����ˮ�ص���״Һ�塣

��ش��������⣺
��1��X Ԫ�ص�����������Ӧ��ˮ����������ӹ���Ϊ________________��
��2��n��ˮ���ܽ��_________������ڡ���С�ڡ���n��p���ܽ�ȣ������ǣ�______________��
��3��n ��p ��Ӧ�Ļ�ѧ����ʽΪ��______________��
��4������ʽΪX4W8���л�����______________��ͬ���칹��(����˳���칹)��
��5�����л�����������p��ͬϵ�����______________��
A�� B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�����е�����CaCl2��MgCl2��Na2SO4,��������:
![]()
�����й�˵���У�����ȷ����
A. ��ȥMg2+����Ҫ��Ӧ: Mg2++ 2OH-=Mg(OH)2��
B. �Լ���һ������Na2CO3��Һ
C. ����SO42-�Ƿ����:ȡ������Һ����ϡ�����ữ���ټ�BaCl2��Һ
D. ��Һ��ϡ����ʱֻ������Ӧ: H+ +OH- =H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KOH��KAlO2�����Һ�еμ�ϡ����ֱ������,���ɳ������������������ϵ��ͼ����ȷ����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com