
【题目】把2.7 g铝投入100 mL 3 mol·L-1的NaOH溶液中充分反应后,再滴入1 mol·L-1的盐酸溶液400 mL,其结果错误的是
A. 溶液显酸性B. 得到澄清透明溶液
C. 得到浑浊溶液D. 溶液中铝元素有两种微粒存在形式
【答案】B
【解析】
铝与NaOH发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,2.7gAl的物质的量为![]() =0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,显然NaOH过量,然后求出生成NaAlO2的量,滴入盐酸,发生NaOH+HCl=NaCl+H2O,然后再根据量进行分析。
=0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,显然NaOH过量,然后求出生成NaAlO2的量,滴入盐酸,发生NaOH+HCl=NaCl+H2O,然后再根据量进行分析。
2.7gAl的物质的量为![]() =0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,铝与NaOH发生反应:
=0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,铝与NaOH发生反应:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
0.1 0.3
氢氧化钠过量,剩余NaOH的量为0.2mol,产生NaAlO2的量为0.1mol,滴加盐酸,n(HCl)=400×10-3L×1mol·L-1=0.4mol,
发生NaOH+HCl=NaCl+H2O,
0.2 0.2
剩余HCl的物质的量0.2mol,然后发生AlO2-+H++H2O=Al(OH)3↓,
0.1 0.2 0.1
然后发生Al(OH)3+3H+=Al3++3H2O,
0.1 0.1
盐酸不足,完全反应,氢氧化铝还有剩余,
A、根据上述分析,溶液中有AlCl3,AlCl3为强酸弱碱盐,溶液显酸性,故A说法正确;
B、根据上述分析,氢氧化铝还有剩余,得到浑浊溶液,故B说法错误;
C、根据B选项分析,故C说法正确;
D、铝元素存在Al(OH)3和Al3+两种形式,故D说法正确;
答案为B。


科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为6A+2 D![]() 3B+4C
3B+4C
B. 反应进行到1 s时,v(A)=v(B)
C. 反应进行到5 s时,B的平均反应速率为0.06mol/(L·s)
D. 反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1mol/L氨水分别滴定20.0mL 0.1mol/L的盐酸和醋酸,曲线如图所示,下列叙述中不正确的是
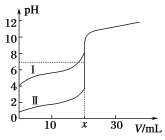
A. x=20
B. Ⅰ曲线表示的是滴定醋酸的曲线
C. 滴定过程中![]() 的值逐渐减小
的值逐渐减小
D. 当Ⅰ曲线和Ⅱ曲线pH均为7时,某一溶液中的c(Cl-)大于另一溶液中的c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家倡导推进传统产业改造升级,引导企业创新优化产业结构。其根本目的是节能减排,“减排”的关键是减少CO2排放,而“减排”的重要手段是合理利用CO2。回答下列问题:
(1)CO2的电子式是___。
(2)利用CO2可合成尿素[CO(NH2)2],合成原料除CO2外,还有NH3。该方法制备尿素的化学方程式是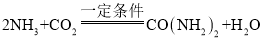 ,该方法制备尿素一般需
,该方法制备尿素一般需![]() >2,即NH3过量,原因是____。
>2,即NH3过量,原因是____。
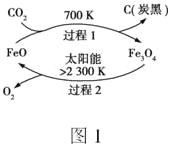
(3)利用太阳能,以CO2为原料制取炭黑的流程如图1所示:一定条件“过程1”生成1mol炭黑的反应热为ΔH1;“过程2”的热化学方程式为:2Fe3O4(s)![]() 6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为___。
6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为___。
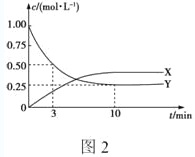
(4)将1mol CO2和3mol H2充入容积为1L的恒容密闭容器中,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
①图2是测得的该反应中X、Y的浓度随时间变化的曲线,其中X为___(写化学式),反应达到平衡时的平均反应速率v(H2)=____mol·L-1·min-1。
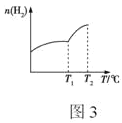
②不同温度下平衡时,混合气体中H2的物质的量随温度的变化曲线如图3所示,则该反应的ΔH____0(填“>”“<”或“不能确定”);测定温度小于T2时,反应体系中无O2存在,则T1~T2的温度范围内,H2的物质的量急剧增大的原因可能是____。
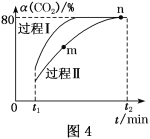
(5)CO2还可以合成甲醇:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=___。
H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg和SiO2在高温下反应生成MgO和Mg2Si。下列说法正确的是
A. 物质的熔点:Mg>MgOB. 氧元素不存在同素异形体
C. Mg的还原性强于SiD. 该反应是置换反应,镁元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量为______、______、________
(2)在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为_________。
(3)一种不纯的铁,已知它含有铜、铝、镁等一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4作用,生成H2 2.24L(标准状况),则此铁块中一定含有的金属杂质是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式:
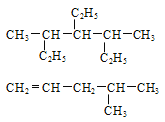
(1)_____________
(2)_____________
(3)4,4,5-三甲基-2-己炔 _______________
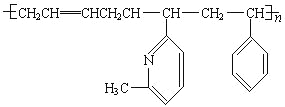
(4)新型弹性材料“丁苯吡橡胶”的结构简式如下:其单体为______________(有几种写几种)
(5)如下表所示,为提纯下列物质(括号内为少量杂质),填写所选用的除杂试剂与主要分离方法
不纯物质 | 除杂试剂 | 分离方法 | |
1 | 溴苯(Br2) | __________ | __________ |
2 | 乙醛(乙酸) | __________ | __________ |
3 | 乙酸乙酯(乙酸) | __________ | __________ |
4 | 乙醇(苯酚) | __________ | __________ |
5 | 硝基苯(硝酸) | __________ | __________ |
(6)①C5H12O的醇,在一定条件下能发生催化氧化反应,产物能与新制的氢氧化铜反应生成红色沉淀,醇的核磁共振氢谱中有三组峰,写出满足上述条件的醇的结构简式______
②C5H12O的醇,在一定条件下不能发生消去反应,写出满足条件的醇的结构简式______
③分子式为C5H12O,不能与金属钠反应.核磁共振氢谱中有四组峰,峰的面积比为3:2:1:6,写出满足上述条件的物质的结构简式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:________;
(2)已知H2(g)和C(S)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;则反应C(S)+ 2H2(g)=CH4(g)的反应热⊿H=______________;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为:___________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
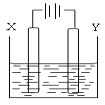
①请写出电解过程中阴极附近观察到的现象:___________________。
②到燃料电池消耗2.8LO2(标准状况下)时,计算此时NaCl溶液的pH=____(假设溶液的体积不变,气体全部从溶液中逸出)。
在Y极通过的电子的物质的量为:______________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质_____(填名称),溶液中Cl―流向___极(填“X”或“Y”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com