


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.其逆过程在相同条件下也必定是自发的 |
| B.其逆过程在相同条件下也可能是自发的 |
| C.其逆过程在其它条件下也可能是自发的 |
| D.自发过程与外界条件无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO3、O2中 | B.SO3、SO2中 |
| C.SO3、SO2、O2中 | D.SO2、O2中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+172.51kJ/mol | B.-283.01kJ/mol |
| C.+283.01kJ/mol | D.+504.00kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ||
| 1 |
| 2 |
| 1 |
| 2 |
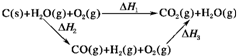
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图中五点KW间的关系B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.外界条件不能改变平衡状态 | B.正、逆反应速率相等 |
| C.各组分的含量不随时间而变化 | D.是动态平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com