
| 化学键 | C≡O | C=O | C-H | H-H |
| 能量/kJ•mol-1 | 1074 | 803 | 413 | 436 |
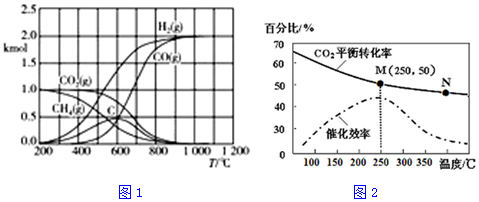
分析 (1)化学反应中的热量=反应物键能总和-生成物键能总和;
(2)比较体系的浓度商与化学平衡常数,判断化学平衡移动方向;
(3)据C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO来分析;
(4)①温度越高,反应速率越大;
②该反应是放热反应,升温平衡逆向移动;
③反应是放热反应,温度升高平衡逆向进行;
④温度越低催化剂活性越小,反应速率越慢;
(5)①CO2(g)+CH4(g)?2CO(g)+2H2(g)的平衡常数为K1=$\frac{{c}^{2}(CO){c}^{2}({H}_{2})}{c(C{O}_{2})c(C{H}_{4})}$,
②H2O(g)+CH4(g)?CO(g)+3H2(g)的平衡常数为K2=$\frac{c(CO){c}^{3}({H}_{2})}{c({H}_{2}O)c(C{H}_{4})}$,
③C(g)+H2O(g)?CO(g)+H2(g)的平衡常数为K3=$\frac{c(CO)c({H}_{2})}{c(C)c({H}_{2}O)}$,则反映C(g)+CO2(g)?2CO(g)K=$\frac{{c}^{2}(CO)}{c(C)c(C{O}_{2})}$=$\frac{{K}_{3}{•K}_{1}}{{K}_{2}}$,据此进行分析;
解答 解:(1)反应过程中能量变化分析可知,CH4(g)+CO2(g)?2CO(g)+2H2(g),故△H=4×413KJ/mol+2×803KJ/mol-2×1074KJ/mol-2×436KJ/mol=+238KJ/mol,
故答案为:+238KJ/mol;
(2)达平衡时H2的体积分数为0.4,故n平(H2)=0.4×(6mol+6mol)=4.8mol,c平(H2)=$\frac{4.8mol}{4L}$=1.2mol/L,
CO2(g)+CH4(g)?2CO(g)+2H2(g)
开始(c) 1.5 1.5 0 0
变化 0.6 0.6 1.2 1.2
平衡 0.9 0.9 1.2 1.2,故k$\frac{{c}^{2}(CO)•{c}^{2}({H}_{2})}{c(C{O}_{2})•c(C{H}_{4})}$=$\frac{1.{2}^{2}×1.{2}^{2}}{0.9×0.9}$=2.56,同时充入2.0mol CO2、6.0mol CH4、4.0mol CO和8.0mol H2,则各物质浓度分别为:c(CO2)=0.5mol/L,c(CH4)=1.5mol/L,c(CO)=1mol/L,c(H2)=2mol/L,浓度商$\frac{{1}^{2}×{2}^{2}}{0.5×1.5}$=5.33>2.56,即化学平衡向逆反应方向移动,
故答案为:逆反应;
(3)C减少的原因是C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO,
故答案为:C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO;
(4)①温度越高,反应速率越大,但M、N点温度、催化剂均不同,则N点速率不最大,故①不正确;
②温度低于250℃时,随温度升高平衡逆向进行乙烯的产率减小,故②不正确;
③升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故③正确;
④为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故④不正确;
故答案为:①②④;
(5)①CO2(g)+CH4(g)?2CO(g)+2H2(g)的平衡常数为K1=$\frac{{c}^{2}(CO){c}^{2}({H}_{2})}{c(C{O}_{2})c(C{H}_{4})}$,
②H2O(g)+CH4(g)?CO(g)+3H2(g)的平衡常数为K2=$\frac{c(CO){c}^{3}({H}_{2})}{c({H}_{2}O)c(C{H}_{4})}$,
③C(g)+H2O(g)?CO(g)+H2(g)的平衡常数为K3=$\frac{c(CO)c({H}_{2})}{c(C)c({H}_{2}O)}$,则反应C(g)+CO2(g)?2CO(g)K=$\frac{{c}^{2}(CO)}{c(C)c(C{O}_{2})}$=$\frac{{K}_{3}{•K}_{1}}{{K}_{2}}$,
故答案为:$\frac{{K}_{3}{•K}_{1}}{{K}_{2}}$.
点评 本题考查盖斯定律、电解原理、化学平衡计算等知识点,侧重考查学生图象分析、计算能力,明确化学反应原理、电解原理是解本题关键,难点是电极反应式的书写,题目难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | MgCl2与NaOH均既含离子键又含共价键,均属离子化合物 | |
| B. | BaCO3与H2SO4化学键类型不完全相同,均属强电解质 | |
| C. | 乙醇与醋酸,均只含共价键,均属非电解质 | |
| D. | 氯气与氧气,均只含共价键,均只做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | X和Y两种元素可形成多种二元化合物 | |
| C. | X、Z和W三种元素形成的化合物属于强电解质 | |
| D. | 元素的非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.
2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂. (C7H10)是一种重要的高密度液体燃料化学推进剂.已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂.已知:| 燃料 | 密度(g•cm-3) | 体积热值(J•L-1) |
| 降冰片烯 | 1.0 | 4.2×107 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢是一种清洁的可再生能源.
氢是一种清洁的可再生能源.| 化学键 | H-H(g) | H-O(g) | O≡O(g) |
| 键能(KJ/mol) | 436 | 463 | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
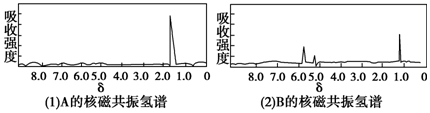
| A. | A是C3H8;B是C6H6 | B. | A是C4H10;B是C6H6 | ||
| C. | A是C3H6;B是C3H6 | D. | A是C3H6;B是C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
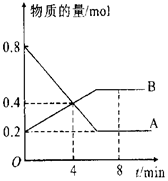 在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题:
在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com