
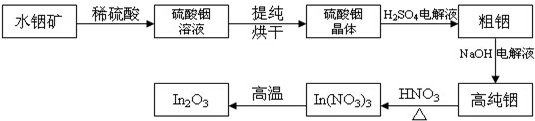
���� ����Ҫ�ɷ�ΪIn��OH��3��ˮ�����ܽ���ϡ���ᣬ��������к�ԭ���õ�����������Һ������Һ����Ũ������ȴ�ᾧ�����˲�ϴ�ӡ�����õ����������壬�����þ�����ϡ�����Ϻ���ɵõ�����������NaOH��ҺΪ���Һ�����д��������ٵ��ߴ�������ߴ����ܽ���ϡ���ᣬ��ͨ�����ȴٽ��������ֽ�ɵõ�In2O3��
��1����������к�ԭ����֪����In��OH��3�ܽ���ϡ���ᣬ���ɿ����Ե���������ˮ���ݴ˿�д���˷�Ӧ�����ӷ���ʽ��
��2���ӿ������ε���Һ�л�����ʣ�ͨ��ʹ�õķ����������ᾧ��
��3����ͭ����ʱ��ͭ����������ͭ������������ͭ���ӵ�����Һ�����Һ�����ݴ�ԭ��ѡ��������ʱ�����������缫���ϼ���д�缫��Ӧʽ������������������ In3+�Ļ�ԭ��Ӧ��
��4�������β��ȶ��������ֽ⣬�ϻ��ý����������ηֽ����Ϊ��������������������������ɽ�ϵ����غ��ԭ���غ���д����ƽ�˷�Ӧ����ʽ��
��5��������Ӧֻ��CO��CO2�����壬����������Ϊ���壬����ƽ�ⳣ���ļ��㹫ʽ���м���n��CO����n��CO2����
�����ɸ��ݷ�Ӧԭ��In2O3+CO?2InO+CO2����������ʽ��ƽ�ⳣ���ļ��㹫ʽ���м��㣻
��6��NO2������Ա�Na2O2ֱ�����գ�����NO2Ϊ��ԭ����Na2O2Ϊ���������ɽ�ϵ����غ���㣻NO2�������ж����壬���������ŷţ���Ի�������ҪΣ���й⻯ѧ����������ȣ�
��� �⣺����Ҫ�ɷ�ΪIn��OH��3��ˮ�����ܽ���ϡ���ᣬ��������к�ԭ���õ�����������Һ������Һ����Ũ������ȴ�ᾧ�����˲�ϴ�ӡ�����õ����������壬�����þ�����ϡ�����Ϻ���ɵõ�����������NaOH��ҺΪ���Һ�����д��������ٵ��ߴ�������ߴ����ܽ���ϡ���ᣬ��ͨ�����ȴٽ��������ֽ�ɵõ�In2O3��
��1��In��OH��3�ܽ���ϡ���ᣬ������Ӧ�����ӷ���ʽΪIn��OH��3+3H+=In3++3H2O���ʴ�Ϊ��In��OH��3+3H+=In3++3H2O��
��2��������������Һ�л������������ķ���������Ũ������ȴ�ᾧ�����ˡ�ϴ�Ӻ���ʴ�Ϊ������Ũ������ȴ�ᾧ��
��3��������ʱ������Ϊ���������� In3+������ԭ��Ӧ�ĵ缫��ӦΪIn3++3e-=In���ʴ�Ϊ��������In3++3e-=In��
��4�������������ֽ⣬����Ϊ�����������������������������ݵ����غ��ԭ���غ�ɵô˷�Ӧ����ʽ��ʽ��4In��NO3��3$\frac{\underline{\;����\;}}{\;}$ 2In2O3+12NO2��+3O2�����ʴ�Ϊ��4 2 12 NO2 3 O2��
��5��������ӦIn2O3+CO?2InO+CO2��ƽ�ⳣ��K=$\frac{c��C{O}_{2}��}{c��CO��}$=0.25������ͬһ�����У������Ũ�ȱȵ������ʵ���֮�ȿ�֪��n��CO����n��CO2��=4���ʴ�Ϊ��4��
��.0.02mol��In2O3��s���ڷ�Ӧ�ﵽƽ��ʱת����Ϊ50%����֪�μӷ�Ӧ��In2O3������Ϊ0.01mol��ͬʱ�μӷ�Ӧ��CO�����ɵ�CO2�����ʵ���ҲΪ0.01mol���ݢ�֪ƽ��ʱn��CO����n��CO2��=4������x-0.01����0.01=4�����x=0.05mol���ʴ�Ϊ��0.05mol��
��6��672mLNO2��������ʵ���Ϊ$\frac{0.672L}{22.4L/mol}$=0.03mol����nmolNa2O2ֱ�����գ�����ݵ����غ㣺0.03mol��1=nmol��2����ã�n=0.015mol��Na2O2������Ϊ0.015mol��78g/mol=1.17g������NO2�����ŵ������У�����ɹ⻯ѧ���������������꣬�ʴ�Ϊ��1.17���⻯ѧ���������������꣮
���� �������Ʊ�In2O3Ϊ���壬�ۺϿ��������Ʊ����̵IJ��������ۣ��漰��Ӧԭ����̽���������ķ����ᴿ�����ԭ����Ӧ�ü�������ԭ��Ӧ����ƽ����㣬�ۺ��Խ�ǿ����һ���Ѷȣ�������ѧ���������֪ʶ�������⡢��������������һ��������


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���һԪǿ�� | B�� | Cl2���ǵ���� | C�� | CO2������� | D�� | NaHSO4����ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʱˮ��ת����Ϊ71.4% | |
| B�� | ��ʱCO2���������Ϊ20.4% | |
| C�� | ������������ͨ��5mol H2O����ﵽ��ƽ��ʱ��H2O��ת�������� | |
| D�� | ��������������5mol H2O����ﵽ��ƽ��ʱ��CO��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A�� | ��Ӧǰ2 min��ƽ������v��Z��=2.0��10-3mol•L-1•min-1 | |
| B�� | �����������䣬�����¶ȣ�����Ӧ���������淴Ӧ���ʼ�С | |
| C�� | ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44 | |
| D�� | �����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�����������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2min�ڣ���NO��ʾ�ĸ÷�Ӧ��ƽ���ٶ�v��NO��=0.03mol•L-1•min-1 | |
| B�� | �����ڻ�������ܶȱ��ֲ������˵����Ӧ�ﵽƽ��״̬ | |
| C�� | T��ʱ���÷�Ӧ��ƽ�ⳣ��K=$\frac{9}{32}$ | |
| D�� | �����¶ȣ�������߷�Ӧ���ʺ�NO��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | X | Y | Z |
| ��ʼŨ��/mol•L-1 | 0.1 | 0.2 | 0 |
| 2 minĩŨ��/mol•L-1 | 0.08 | a | b |
| ƽ��Ũ��/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A�� | ƽ��ʱ��X ��ת����Ϊ20% | |
| B�� | t��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ40 | |
| C�� | ����ƽ������ϵѹǿ��v������v����С��ƽ��������Ӧ�����ƶ� | |
| D�� | ǰ2 min �ڣ���Y �ı仯����ʾ��ƽ����Ӧ����v��Y��=0.03 mol•L-1•min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
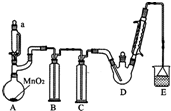 ij̽��С�������ͼ��ʾװ�ã��г֡����������ԣ���ģ�ҵ���������Ʊ�������ȩ��CCl3CHO����ʵ�飮�������ϣ��й���Ϣ���£�
ij̽��С�������ͼ��ʾװ�ã��г֡����������ԣ���ģ�ҵ���������Ʊ�������ȩ��CCl3CHO����ʵ�飮�������ϣ��й���Ϣ���£�| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| ��Է������� | 46 | 147.5 | 163.5 | 64.5 |
| �۵�/�� | -114.1 | -57.5 | 58 | -138.7 |
| �е�/�� | 78.3 | 97.8 | 198 | 12.3 |
| �ܽ��� | ��ˮ���� | ������ˮ���Ҵ� | ������ˮ���Ҵ���������ȩ | ����ˮ���������Ҵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ú��������ú������ռ����Ҫ��λ��������Ȼ�ǻ�ѧ��ҵ����Ҫ��ɲ��֣�
ú��������ú������ռ����Ҫ��λ��������Ȼ�ǻ�ѧ��ҵ����Ҫ��ɲ��֣�| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molCH4��4molCl2�ڹ�������ȫ��Ӧ������1molCCl4 | |
| B�� | ���顢�����Ҵ������������������һ�������¶��ܷ���ȡ����Ӧ | |
| C�� | ��ϩ�ܱ����Ը��������Һ�������������� | |
| D�� | 1�����C2H4��ȫȼ����ͬ��ͬѹ��3�����O2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com