
���� ��1������Ԫ��ԭ�ӵĺ��������������������ԭ����д��������Ų�ʽ��
��2��ͬһ�����У�Ԫ�صĵ�һ����������ԭ�������������������VA��Ԫ�صĵ�һ�����ܴ���������Ԫ�أ�ͬһ����Ԫ�أ�Ԫ�صĵ�һ����������ԭ���������������С��
��3������˫��ˮ���ӵĽṹʽȷ�������ʷ��ӵĽṹʽ��ע��ÿ��ԭ�Ӷ��ﵽ�ȶ��ṹ��
��4�����þ�̯��ȷ���仯ѧʽ��
��5�������ܶȺ�Ħ���������㣬V=$\frac{m}{��}$��
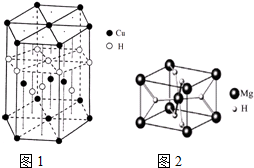
��� �⣺��1��CuΪ29��Ԫ�أ�ԭ�Ӻ�����29�����ӣ������������ԭ�������������Ų�ʽΪ��1s22s22p63s23p63d104s1��[Ar]3d104s1��
�ʴ�Ϊ��1s22s22p63s23p63d104s1��[Ar]3d104s1��
��2��N��OԪ�ش��ڵڶ����ڣ���NԪ�ش��ڵ�VA�壬OԪ�ش��ڵ�VIA�壬SԪ�ش��ڵ������ڵ�VIA�壬����������Ԫ�صĵ�һ�����ܴ�С˳����N��O��S��
�ʴ�Ϊ��N��O��S��
��3��S2Cl2���ӽṹ��H2O2���ƣ�S2Cl2��������ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ���ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�������ṹʽΪ��Cl-S-S-Cl��
�ʴ�Ϊ��Cl-S-S-Cl��
��4���þ����к���ͭԭ�Ӹ���ͭԭ�Ӹ���=4+2��$\frac{1}{2}$+12��$\frac{1}{6}$=7��Hԭ�Ӹ���=1+3+6��$\frac{1}{3}$=7������ͭԭ�Ӻ���ԭ�Ӹ�������1��1�����仯ѧʽΪCuH��
�ʴ�Ϊ��CuH��
��5��Mgλ�ڶ�������ģ���ĿΪ8��$\frac{1}{8}$+1=2��Hλ�����ģ���ĿΪ��8��$\frac{1}{2}$=4��˵���þ�������2��MgH2��������Ϊ$\frac{2��26}{{N}_{A}}$g���������Ϊ��V=$\frac{m}{��}$=$\frac{52}{a•{N}_{A}}$cm3��
�ʴ�Ϊ��$\frac{52}{a•{N}_{A}}$��
���� ���⿼�������ʽṹ�����ʣ���Щ֪ʶ�㶼�ǿ����ȵ㣬�״���һ�ǵ�һ�����ܱ仯���Ƽ��쳣�����״�����Ǹ���ڣ�4��С����ÿ�������ϵ�ԭ�ӱ�6������ռ�ж�����8������ռ�У������Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| ��ʼ����ʱ | 1.5 | 3.3 | 6.5 | 9.4 |
| ������ȫʱ | 3.7 | 5.2 | 9.7 | 12.4 |
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
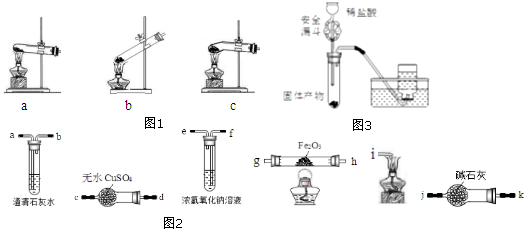
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | B�����ʵ���Ũ�� | B�� | ��������ѹǿ | ||
| C�� | ������������ʵ��� | D�� | v��C����v��D���ı�ֵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO32-��OH-��Na+��H+ | B�� | Al3+��Na+��Cl-��AlO2- | ||
| C�� | Ba2+��HCO3-��K+��SO42- | D�� | S2-��H+��SO42-��Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
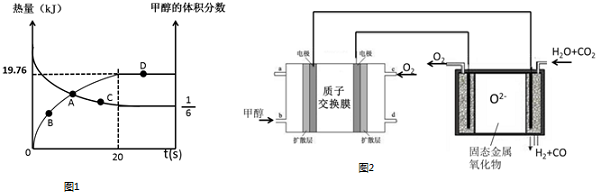
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
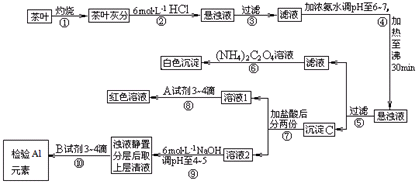
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��Һ�ܿ���ɫ | B�� | ��Һ����ɫ | C�� | ���ֳ��� | D�� | �����ֳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
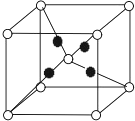 A��B��C��D��E��F��G ԭ��������������A �� B ��ͬ���ڣ���̬ B ԭ�Ӻ������ռ�� 3 ���ܼ���ÿ���ܼ��ϵ�������ȣ�D ���γ������������ҵ��������ֱ�Ϊ 10��18��E �Ƕ����ڵ縺����ǿ��Ԫ�أ���̬ F �ļ۲�����Ų�ʽΪ ns xnp y���� n=x+y����̬��+1 �� G ���Ӻ������ǡ�������������Ӳ㣮
A��B��C��D��E��F��G ԭ��������������A �� B ��ͬ���ڣ���̬ B ԭ�Ӻ������ռ�� 3 ���ܼ���ÿ���ܼ��ϵ�������ȣ�D ���γ������������ҵ��������ֱ�Ϊ 10��18��E �Ƕ����ڵ縺����ǿ��Ԫ�أ���̬ F �ļ۲�����Ų�ʽΪ ns xnp y���� n=x+y����̬��+1 �� G ���Ӻ������ǡ�������������Ӳ㣮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com