
 将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )
将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )| A、在进行到3分钟时,CO2和H2所表达的反应速率值相等,均为0.5mol?L-1?min-1 | ||
| B、此反应的热化学方程式为:CO2(g)+3H2(g)?CH4O(g)+H2O(g)△H=-49.0KJ/mol | ||
C、此条件下反应的平衡常数为
| ||
| D、降低温度,此反应的平衡常数可能为0.8 |
| △c |
| △t |
| 44g |
| 1000g |
| 2.00mol/L-1.25mol/L |
| 3min |
| 0.75mol/L |
| 3min |
| 3.00mol/L-0.75mol/L |
| 3min |
| 2.25mol/L |
| 3min |
| 1000g |
| 44g/mol |
| 0.75×0.75 |
| 0.753×1.25 |


科目:高中化学 来源: 题型:
| A、常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 |
| B、铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀 |
| C、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
| D、次氯酸钠具有强氧化性,可用于配制消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
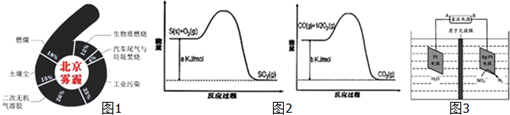
| 催化剂 |
| 180℃ |
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体M能与水反应生成X单质和一种强碱 |
| B、Z单质的薄片在酒精灯上加热能熔化,但不滴落 |
| C、Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 |
| D、M和N中均含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、Y2+的半径比T2-的半径大 |
| C、Z2R3不能在水溶液中存在 |
| D、元素X和T形成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
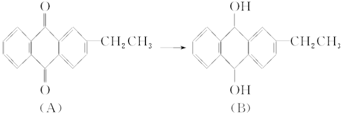
| A、B的分子式为C16H14O2 |
| B、上述转化属于还原反应 |
| C、二者均为芳香烃 |
| D、二者均能发生加成、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
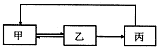 下表中各组物质之间不能通过一步反应实现如图转化的是( )
下表中各组物质之间不能通过一步反应实现如图转化的是( )| 甲 | 乙 | 丙 | |
| A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
| B | SiO2 | H2SiO3 | Na2SiO3 |
| C | Cl2 | HCl | CuCl2 |
| D | AlCl3 | Al(OH)3 | Al2O3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com