
| ||
| ||


 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
 设nA为阿伏加德罗常数的值,下列叙述正确的是( )
设nA为阿伏加德罗常数的值,下列叙述正确的是( )| A、常温常压下,16g14CH4所含中子数目为8nA |
| B、标准状况下,22.4 LCCl4所含分子数目为nA |
| C、1 L 0.5 mol?L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5nA |
| D、6.2g白磷(分子式为P4,分子结构如图所示)所含P-键数目为0.3nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
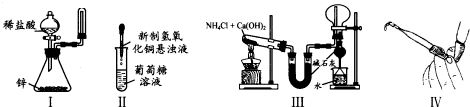
| A、实验I:制取并收集氢气 |
| B、实验II:验证葡萄糖的还原性 |
| C、实验III:实验室制氨气并收集干燥的氨气 |
| D、实验Ⅳ:检查碱式滴定管是否漏液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O2和水完全反应,转移电子数为2nA |
| B、0.5L0.2mol?L-1FeCl3溶液中,含Fe3+离子数为0.1nA |
| C、理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为nA |
| D、常温常压下,28g乙烯和丙烯混合气体含有的碳原子总数为2.5nA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用激光笔鉴别淀粉溶液和蔗糖溶液 |
B、 实验室采用如图所示装置收集SO2 实验室采用如图所示装置收集SO2 |
| C、除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 |
| D、配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A |
| 3 |
| 3A |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com