
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA
B.1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA
C.2.0g H218O与D2O的混合物中所含中子数为NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3﹣物质的量浓度大于3 mol/L
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:简答题
五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
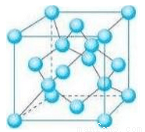
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:选择题
下列实验能达到相应目的的是
A. 用乙醇萃取溴水中的溴单质
B. 用干燥的pH试纸测定新制氯水的pH
C. 向NH4Cl溶液中滴加石蕊试液,溶液变红,证明NH4Cl发生了水解反应
D. 向蒸馏水中滴加过量的饱和FeCl3溶液,并不断搅拌,制取Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2017届江西省九江市十校高三第二次联考理科综合化学试卷(解析版) 题型:选择题
分子式为C4H10O的醇与分子式为C8H8O2且含苯环的羧酸在一定条件下反应生成酯的种类有( )
A. 4种 B. 8种 C. 12种 D. 16种
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:选择题
下列有机反应属于加成反应的是
A.CH4 + Cl2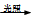 CH3Cl + HCl
CH3Cl + HCl
B.CH2==CH2 + Br2 CH2BrCH2Br
CH2BrCH2Br
C.2CH3CH2OH + O2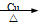 2CH3CHO + 2H2O
2CH3CHO + 2H2O
D.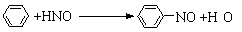
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一3月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
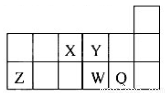
A. 离子Y2-和Z 3+的核外电子数和电子层数都不相同。
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ。
C. 元素X与元素Z的最高正化合价之和的数值等于8。
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:填空题
利用元素周期表,我们可以认识更多元素的性质
(1)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律, 金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。则鉴别说Be(OH)2和Mg(OH)2可选用的试剂为__________溶液。
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素(C)、硅(Si)同主族,常温下其单质在空气中,锡、锗不反应而铅表面生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
① 锗的原子序数为__________;
② 铅(Pb)、锡(Sn)、锗(Ge)的+4价氢氧化物的碱性由强到弱的顺序为__________(填化学式)。
(3)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来最重大突破。己知铷(Rb)是37号元素,质量数是85,与钠同主族。回答下列问题:
①铷在周期表中的位置为___________________
②同主族元素的同类化合物的性质相似,请写出:
AlCl3与过量的RbOH反应的离子方程式:_____________________________
③现有铷和另一种碱金属形成的混合金属50g,当它与足量水反应时,放出标准状况下的氢气22.4L,这种碱金属可能是__________
A.Li B.Na C.K D.Cs
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:简答题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
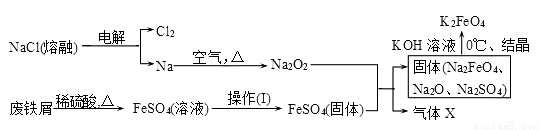
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。
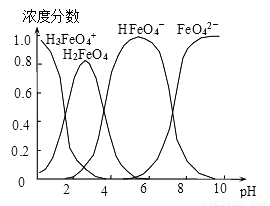
A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
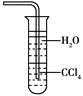
A. 氨既能用浓硫酸干燥也能用无水CaCl2干燥
B. NH3是电解质,所以氨水能导电
C. NH3可以使干燥的红色石蕊试纸变蓝
D. 用水吸收NH3用如图装置可防止倒吸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com