
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。
⑴当加入50mLBa(OH)2溶液时,发生反应的离子方程式为 ,所得溶液中的溶质是 ,其物质的量浓度为 mol·L—1;
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液中溶质 ,则该溶质物质的量浓度为 mol·L-1。
(12分)⑴ 2H++2OH-+Ba2++SO42—==BaSO4↓+2H2O;Na2SO4;0.067
⑵100 ; NaOH ;0.1
【解析】
试题分析:n(Na2SO4)=0.01mol,n(H2SO4)= 0.01mol,n(H+)= 0.02mol,n(SO42—)=0.02mol。
⑴n[Ba(OH)2]=0.01mol,n(OH-)=0.02mol,n(Ba2+)=0.01mol。
发生的离子方程式为2H++2OH-+Ba2++SO42—==BaSO4↓+2H2O。由化学反应中量的关系可知,H+、OH-、Ba2+反应完,SO42—没反应完,Na+没参加反应,故所得溶液中的溶质是Na2SO4。其物质的量浓度为c=n÷V=0.01÷[(100+50) ÷1000]= 0.067(mol·L—1)。
⑵n(SO42—)=0.02mol,当溶液中沉淀量达到最大时,需要n(Ba2+)=0.02mol,故需要n[Ba(OH)2] =0.02mol,即所加Ba(OH)2溶液的体积为V=n÷c=0.02÷0.2=0.1(L),即100mL。n(OH-)=0.04mol,反应0.02mol,剩余0.02mol,H+、O42—反应完,Na+没参加反应,故所得溶液中溶质为NaOH。则该溶质物质的量浓度为c=n÷V=0.02÷[(100+100) ÷1000]= 0.1(mol·L—1)。
考点:化学计量的相关计算 离子方程式的书写
点评:本题考查的是化学计量的相关计算和离子方程式的书写的知识,题目难度中,主要考查学生的计算能力、对公式灵活应用的能力。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 水解 |
| 水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2?L-2 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年安丘中学高二暑期练习化学卷(四) 题型:实验题
⑴下列实验操作或对实验事实的叙述正确的是 (填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
⑦如图,可观察到灵敏检流计的指针偏转;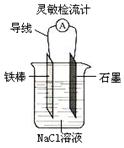
⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶 液的现象相同。
⑵现有0.1mol·L-1的纯碱溶液,用pH试纸测定该溶液的pH,其
正确的操作是
你认为该溶液pH的范围一定介于 之间。请你设计一个简单的实验方案证明纯碱溶液呈碱性是由CO32-引起的: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com