
| A. | 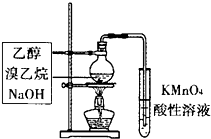 如图检验产物中含有乙烯 | B. | 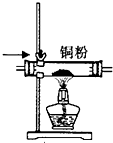 如图除去CO中混有的少量CO2 | ||
| C. | 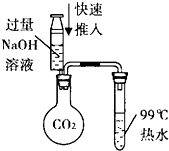 如图验证减压蒸馏原理 | D. | 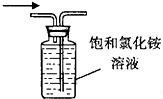 如图收集NH3 |
分析 A.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
B.CO与Cu不反应;
B.减压蒸馏,降低沸腾需要的温度;
D.氨气极易溶于水.
解答 解:A.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则不能检验产物中含有乙烯,故A错误;
B.CO与Cu不反应,不能除杂,应选试剂为CuO,故B错误;
B.减压蒸馏,压强降低,沸点降低,降低沸腾需要的温度,图中装置可验证,故C正确;
D.氨气极易溶于水,不能利用排溶液法收集,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
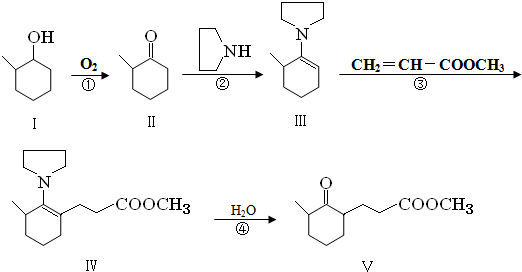
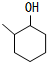 +O2 $→_{△}^{催化剂}$ 2
+O2 $→_{△}^{催化剂}$ 2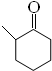 +2H2O(不要求注明反应条件).
+2H2O(不要求注明反应条件).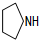 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
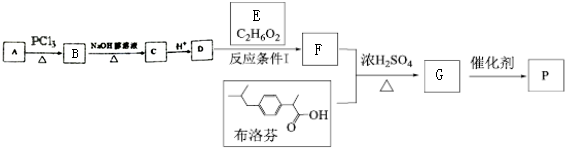
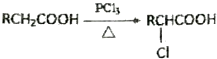
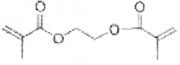 .
. .
.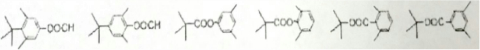 任意2种:①含有苯环和酯基;②其核磁共振氢谱为4组峰,且峰面积比为9:6:2:1.
任意2种:①含有苯环和酯基;②其核磁共振氢谱为4组峰,且峰面积比为9:6:2:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ga(OH)3酸性强于Al(OH)3 | B. | Al(OH)3酸性强于Ga(OH)3 | ||
| C. | Ga(OH)3碱性强于Al(OH)3 | D. | Al(OH)3碱性强于Ga(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | $\frac{53}{84}$<a<$\frac{53}{62}$ | |
| B. | a=$\frac{53}{65}$时,m2中固体为Na2CO3和NaOH | |
| C. | a=$\frac{53}{75}$时,m2中固体为Na2CO3 | |
| D. | 若m1=58.4,m2=56.6,则m1中NaHCO3为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 241Am的中子数与电子数之差为146 | B. | 241Am与243Am的质子数相等 | ||
| C. | 241Am与243Am是同素异形体 | D. | 241Am与243Am的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是实验室制取并探究氯气化学性质的装置图
如图是实验室制取并探究氯气化学性质的装置图查看答案和解析>>
科目:高中化学 来源: 题型:推断题
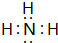 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程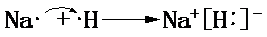 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com