
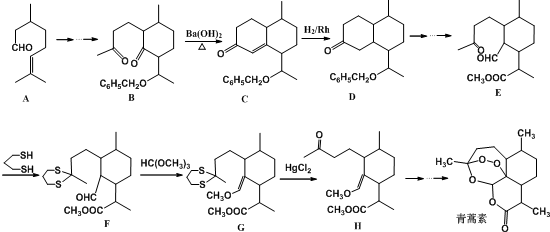
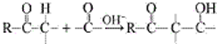
 用系统命名法命名,它的名称是1,3-丙二硫醇;
用系统命名法命名,它的名称是1,3-丙二硫醇;分析 (1)D分子中所含有的官能团名称是羰基和醚键;
(2)A中含氧官能团是醛基,醛基能发生银镜反应、能和新制氢氧化铜悬浊液发生氧化反应;
(3)烃分子中含-OH叫醇,含-SH叫硫醇,物质 用系统命名法命名为1,3-丙二硫醇;
用系统命名法命名为1,3-丙二硫醇;
(4)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α-H与C=O先发生发生加成反应,再发生消去反应生成C;
(5)A的同系物中相对分子质量最小的分子为CH2=CHCHO,与银氨溶液发生反应生成CH2=CH-COONH4、Ag、NH3与H2O;
(6)由E→F的结构可知,羰基中C=O双键变成C-S单键,由G→H的结构可知C-S单键又变成羰基,目的是保护羰基.
解答 解:(1)D分子中所含有的官能团名称是羰基和醚键,故答案为:羰基和醚键;
(2)A中含氧官能团是醛基,醛基能和银氨溶液发生银镜反应、能和新制氢氧化铜悬浊液发生氧化反应生成砖红色沉淀,所以可以用银氨溶液、新制氢氧化铜悬浊液检验,故答案为:银氨溶液或新制氢氧化铜悬浊液;
(3)烃分子中含-OH叫醇,含-SH叫硫醇,物质 用系统命名法命名为1,3-丙二硫醇,
用系统命名法命名为1,3-丙二硫醇,
故答案为:1,3-丙二硫醇;
(4)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α-H与C=O先发生发生加成反应,再发生消去反应生成C,则反应类型依次是加成反应、消去反应,
故答案为:加成反应;消去反应;
(5)A的同系物中相对分子质量最小的分子为CH2=CHCHO,与银氨溶液发生反应生成CH2=CH-COONH4、Ag、NH3与H2O,反应方程式为:CH2=CH-CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2=CH-COONH4+2Ag↓+3NH3+H2O,
故答案为:CH2=CH-CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2=CH-COONH4+2Ag↓+3NH3+H2O;
(6)由E→F的结构可知,羰基中C=O双键变成C-S单键,由G→H的结构可知C-S单键又变成羰基,目的是保护羰基,
故答案为:保护羰基.
点评 本题考查有机物推断与合成,是对有机化学基础的综合考查,侧重考查学生分析推理能力,明确反应前后物质结构变化与反应类型的关系是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NF3中只含有极性共价键 | |
| B. | NF3既是氧化产物,又是还原产物 | |
| C. | NH4F中既含有离子键又含有共价键 | |
| D. | 上述反应中,反应物和生成物均属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2、Na2SO3、FeCl3、KCl | B. | Na2CO3、NaHCO3、KNO3、NH4Cl | ||
| C. | NH3•H2O、H3PO4、Na2SO4、H2SO4 | D. | NaCl、CH3COOH、AlCl3、NaHSO4、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com