
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
| A.盐酸 | B.酒精 | C.乙酸 | D.苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓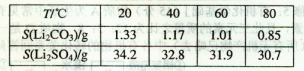
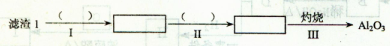
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜合金 | B.陶瓷 | C.聚乙烯 | D.二氧化硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
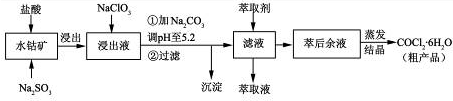
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
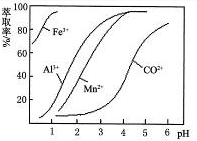
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| B.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 |
| C.推广燃煤脱硫技术,可以防治SO2污染 |
| D.凡含有食品添加剂的食物对人体健康均有害,不宜食用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
 。
。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。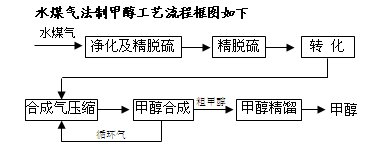
 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ; 措施是 ;(填字母代号)
措施是 ;(填字母代号)| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
 CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4[ |
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.蛋白质、纤维、蔗糖、聚乙烯、淀粉都是高分子化合物 |
| B.研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 |
| C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 |
| D.石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com