
| 选项 | 实验设计 | 实验目的 |
| A | 在热的NaOH溶液中滴入饱和FeCl3溶液 | 制备Fe(OH)3胶体 |
| B | 将SO2通入KMnO4溶液 | 验证SO2的漂白性 |
| C | 向含少量Fe3+的MgCl2溶液中加入适量MgCO3粉末,加热、搅拌并过滤 | 除去MgCl2溶液中少量的Fe3+ |
| D | 将0.1mol•L-1的Na2SO4溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1的Na2CO3溶液 | 比较BaCO3与BaSO4溶度积的大小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化铁胶体:在沸水中加入饱和氯化铁溶液,加热至液体呈红褐色为止;
B.二氧化硫具有还原性,能被强氧化剂氧化;
C.Fe3+水解溶液显酸性,Fe3++3H2O?Fe(OH)3+3H+,在加热搅拌的条件下加入碳酸镁,水解吸热,加热搅拌的条件促进水解,碳酸镁和氢离子反应生成镁离子和CO2,从而促进铁离子水解;
D.浓度商大于溶度积时产生沉淀.
解答 解:A.氢氧化铁胶体:在沸水中加入饱和氯化铁溶液,加热至液体呈红褐色为止,氯化铁和NaOH溶液反应生成氢氧化铁沉淀而不能制备氢氧化铁胶体,故A错误;
B.二氧化硫具有还原性,能被强氧化剂酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该反应中二氧化硫体现还原性,故B错误;
C.Fe3+水解溶液显酸性,Fe3++3H2O?Fe(OH)3+3H+,在加热搅拌的条件下加入碳酸镁,水解吸热,加热搅拌的条件促进水解,碳酸镁和氢离子反应生成镁离子和CO2,使三价铁离子的水解平衡向正反应方向移动,使三价铁离子变成氢氧化铁沉淀除去,同时实现将杂质转化为纯净物,故C正确;
D.浓度商大于溶度积时产生沉淀,将0.1mol•L-1的Na2SO4溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1的Na2CO3溶液,碳酸根离子和钡离子的浓度商大于其溶度积导致硫酸钡转化为碳酸钡,不能比较溶度积大小,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、物质性质、除杂、溶度积大小比较等知识点,明确实验原理及物质性质是解本题关键,注意二氧化硫漂白性和还原性区别,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 1 mo1•L-1的 Ca(ClO)2溶液中含ClO-数目小于2NA | |
| B. | 1 mo1 N2和3 mol H2在密闭容器中充分反应后,容器中含有 N-H键数为6NA | |
| C. | 1 mol乙烯和乙醇气体的混合物完全燃烧,消耗的氧分子数为3NA | |
| D. | 标准状况下,2.24 L35Cl2中含有的中子数为3.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.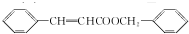 ,下列关于X的说法不正确的是bc(填字母).
,下列关于X的说法不正确的是bc(填字母). 或
或 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
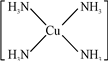 2+.
2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
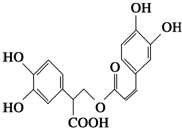
| A. | 迷迭香酸与溴单质只能发生取代反应 | |
| B. | 1 mol迷迭香酸最多能和9 mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1 mol迷迭香酸最多能和5 mol NaOH发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com