
分析 1、HCl和HBr、HI均有还原性;
2.碘单质遇淀粉溶液变蓝色;
3.溴、碘易溶于CCl4;
4.AgBr有感光性,AgCl、AgBr、AgI都是难溶于水的有色物质.
解答 解:1、HCl和HBr、HI均有还原性;故答案为:错;
2.碘单质遇淀粉溶液变蓝色,但是碘离子不能,故答案为:错;
3.溴、碘易溶于CCl4,在CCl4中的溶解度比在水中的溶解度大得多,故答案为:错;
4.AgAgBr有感光性,三者都是难溶于水的有色物质,AgCl是白色、AgBr浅黄色、AgI黄色,故答案为:错.
点评 本题考查学生卤素离子的还原性、单质的物理性质以及卤化银的溶解情况等,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在②的溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| B. | 四种溶液中离子总数的关系:④>③>②>① | |
| C. | 四种溶液中c(H+)的关系:①>②>③>④ | |
| D. | 在①的溶液中:c(H+)=c(HA-)+c(A2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时.将电能转化成化学能 | |
| B. | 充电时,阳极反应为Li++e-═Li | |
| C. | 正极的电极反应式为FeS2+2e-+2Li+═Li2FeS2 | |
| D. | 每转移0.1mol电子,正极材料消耗12.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
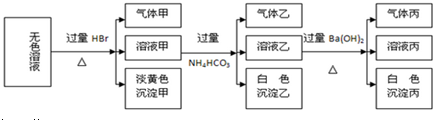
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com