
| ��A | ��A | ��A | ��A | ��A | ��A | ��A | |
| �ڶ����� | �� | �� | �� | �� | |||
| �������� | �� | �� | �� | �� | |||
| �������� | �� | �� |
 ��Ԫ�آۺ͢��γ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽ
��Ԫ�آۺ͢��γ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽ ��Ԫ�آڡ��ܵ���̬�⻯�ﷴӦ��IJ���ĵ���ʽ
��Ԫ�آڡ��ܵ���̬�⻯�ﷴӦ��IJ���ĵ���ʽ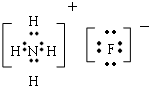 ��
�� ��
�� ��
������ ��Ԫ�������ڱ��е�λ�ÿ�֪�٢ڢۢܢݢޢߢ���ֱ�ΪC��N��O��F��Na��P��S��Cl��Ca��As��Ԫ�أ�
��1��Ԫ�آ�ΪN����Ӧ�ĵ��ʵĽṹʽΪN��N��Ԫ�آ�ΪCl����Ӧ��+1�ۺ�����ĽṹʽΪH-O-Cl��
��2��Ԫ�آٵ����������Ϊ������̼��Ԫ�آۺ͢��γ�ԭ�Ӹ�����Ϊ1��1�Ļ�����Ϊ�������ƣ�Ԫ�آڡ��ܵ���̬�⻯�ﷴӦ��IJ���ΪNH4F��
��3���ܺ͢��γɻ�����ΪCaF2��
��4��Ԫ�صķǽ�����Խǿ����Ӧ���⻯��Խ�ȶ���
��5�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС���ܡ��ݡ��ߡ����γɵļ������У��뾶��������ΪS2-��
��6��Ԫ�صķǽ�����Խǿ����Ӧ������������ˮ���������Խǿ����϶�Ӧ���ʵ����ʵ����Լ���Ӧ�ų���������д�Ȼ�ѧ����ʽ��Ԫ�آݡ��������������ˮ����ֱ�ΪNaOH��HClO4��
��� �⣺��Ԫ�������ڱ��е�λ�ÿ�֪�٢ڢۢܢݢޢߢ���ֱ�ΪC��N��O��F��Na��P��S��Cl��Ca��As��Ԫ�أ�
��1��Ԫ�آ�ΪN����Ӧ�ĵ��ʵĽṹʽΪN��N��Ԫ�آ�ΪCl����Ӧ��+1�ۺ�����ĽṹʽΪH-O-Cl���ʴ�Ϊ��N��N��H-O-Cl��
��2��Ԫ�آٵ����������Ϊ������̼������ʽΪ ��Ԫ�آۺ͢��γ�ԭ�Ӹ�����Ϊ1��1�Ļ�����Ϊ�������ƣ�����ʽΪ
��Ԫ�آۺ͢��γ�ԭ�Ӹ�����Ϊ1��1�Ļ�����Ϊ�������ƣ�����ʽΪ ��Ԫ�آڡ��ܵ���̬�⻯�ﷴӦ��IJ���ΪNH4F������ʽΪ
��Ԫ�آڡ��ܵ���̬�⻯�ﷴӦ��IJ���ΪNH4F������ʽΪ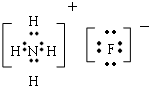 ��
��
�ʴ�Ϊ�� ��
�� ��
��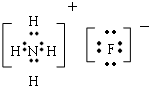 ��
��
��3���ܺ͢��γɻ�����ΪCaF2������ʽ��ʾCaF2�γɻ�����Ĺ���Ϊ ��
��
�ʴ�Ϊ�� ��
��
��4���ǽ�����F��O��S��P��Ԫ�صķǽ�����Խǿ����Ӧ���⻯��Խ�ȶ����ȶ�����������PH3���ʴ�Ϊ��PH3��
��5�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС���ܡ��ݡ��ߡ����γɵļ������У��뾶��������ΪS2-��ԭ�ӽṹʾ��ͼΪ ��
��
�ʴ�Ϊ�� ��
��
��6��Ԫ�صķǽ�����Խǿ����Ӧ������������ˮ���������Խǿ���ޡ��ߡ���ֱ�ΪP��S��As���ǽ�����S�Ľ�ǿ����H2SO4������ǿ��250mL 1mol/L�ĸ���Һ������������ʵ���Ϊ0.25mol����������ϡ��ˮ��Ӧ�ų�������ΪQ1kJ����1mol�ų�4Q1kJ�������Ȼ�ѧ����ʽΪH2SO4��aq��+2NH3•H2O��aq��=��NH4��2SO4��aq��+2H2O��l����H=-4Q1kJ/mol��Ҳ��дΪH+��aq��+NH3•H2O��aq��=NH4+��aq��+H2O��l����H=-2Q1kJ/mol��
Ԫ�آݡ��������������ˮ�����ϡ��Һ��Ӧ����1molˮʱ�ų�Q2kJ������������H+��aq��+OH-��aq��=H2O��l����H=-Q2kJ/mol��
��֪NH3•H2O��aq��?NH4+��aq��+OH-��aq����H=��Q2-2Q1��kJ/mol��
�ʴ�Ϊ��H2SO4��H2SO4��aq��+2NH3•H2O��aq��=��NH4��2SO4��aq��+2H2O��l����H=-4Q1kJ/mol����Q2-2Q1��kJ/mol��
���� ���⿼��λ�á��ṹ�����ʵĹ�ϵ��Ӧ�ã�Ϊ��Ƶ���㣬����Ԫ�ص�λ�á����ʡ�Ԫ�ػ�����֪ʶΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������� | B�� | Ũ���� | C�� | Ũ���� | D�� | �Ȼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.5 mol | B�� | 2 mol | C�� | 1.25 mol | D�� | 0.5 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 15��8��1 | B�� | 13��6��1 | C�� | 9��6��1 | D�� | 6��3��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
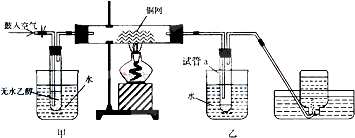
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol�������к���C�TC������ĿΪ3NA | |
| B�� | ��1molNa2CO3����Һ�У���������������NA | |
| C�� | 1molFeI2������������Ӧʱת�Ƶĵ�����Ϊ2NA | |
| D�� | ��״���£�22.4L�����к��е���ԭ����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | MgO | Al2O3 | MgCl2 | AlCl3 |
| ���� | ���ӻ����� | ���ӻ����� | ���ӻ����� | ���ۻ����� |
| �۵�/�� | 2800 | 2050 | 714 | 191 |
 ����������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12kg����������akJ�������÷�Ӧ���Ȼ�ѧ����ʽ��SiCl4��g��+2H2��g��$\frac{\underline{\;����\;}}{\;}$Si��s��+4HCl��g����H=-0.025kJ/mol
����������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12kg����������akJ�������÷�Ӧ���Ȼ�ѧ����ʽ��SiCl4��g��+2H2��g��$\frac{\underline{\;����\;}}{\;}$Si��s��+4HCl��g����H=-0.025kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
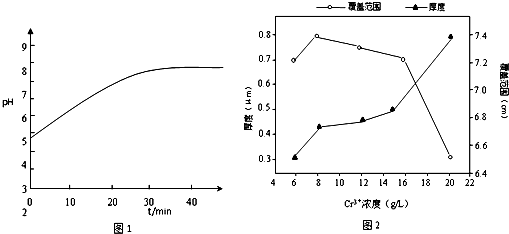
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú����Ȼ����ʯ���Ǵ����� | |
| B�� | ���û�ʯȼ��ȼ�շų�������ʹ�ֽ���������������ܿ������о����� | |
| C�� | ��ѧ��Դ�ŵ硢ֲ�������ö��ܷ�����ѧ�仯��������������ת�� | |
| D�� | ����ѧ�����жϿ���ѧ�����յ����������γɻ�ѧ�����ų�����������Ӧ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com