
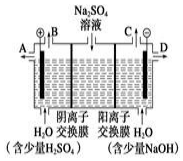
分析 ①电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②阴极上氢离子放电,则NaOH在阴极生成;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液pH升高;
④结合燃烧热方程式及电池反应计算.
解答 解:①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数.
故答案为:4OH--4e-=2H2O+O2↑;<;
②阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出,故答案为:D;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液pH升高;
故答案为:增大;
④H2的燃烧热为285.8kJ/mol,则2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,该燃料电池工作产生36g H2O,n(H2O)=$\frac{36g}{18g/mol}$=2mol,由燃烧的热方程式可知,生成2molH2O放出571.6kJ的热量,即理论上有571.6kJ的能量转化为电能;
故答案为:571.6.
点评 本题考查了原电池和电解池原理,为高频考点,注意装置的判断及燃料原电池电极反应式和电解反应的书写,理解电解质溶液的酸碱性确定生成的离子或物质,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 构成物质一定是化合物 | |
| B. | 构成物质一定是单质 | |
| C. | 构成物质可能只有一种元素 | |
| D. | 物质的组成元素一定是两种或两种以上 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
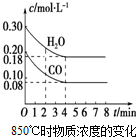 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0| 时间/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.110 | 0.210 | 0.090 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数:N2<O2 | B. | 气体摩尔体积:N2<O2 | ||
| C. | 气体的压强:N2<O2 | D. | 体积:N2<O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
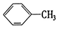 ②
②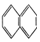 ③
③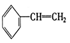 ④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦
④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦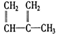 ⑧
⑧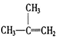
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中氮的化合价为-2.
,其中氮的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 | |
| D. | 味精能增加食品的鲜味,促进食欲,炒菜时应该多放一点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com