
分析 (1)根据n=$\frac{m}{M}$来进行计算;
(2)根据每个分子中含有的原子数计算总原子数;
(3)根据V=nVm计算;
(4)根据公式w%=$\frac{溶质质量}{溶液质量}$×100%以及c=$\frac{1000ρw%}{M}$来计算;
(5)根据c=$\frac{n}{V}$计算.
解答 解:(1)m g某气体的物质的量为$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,故答案为:$\frac{m}{M}$mol;
(2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即为2×$\frac{m}{M}$mol×NAmol-1=$\frac{2m{N}_{A}}{M}$,故答案为:$\frac{2m{N}_{A}}{M}$;
(3)该体积的体积为$\frac{m}{M}$mol×22.4L/mol=$\frac{22.4m}{M}$L,故答案为:$\frac{22.4m}{M}$;
(4)溶液中溶质的质量分数为w%=$\frac{溶质质量}{溶液质量}$×100%=$\frac{m}{m+1000}$×100%=$\frac{100m}{m+1000}$%,该溶液的物质的量浓度c=$\frac{1000ρw%}{M}$mol/L=$\frac{1000ρ×\frac{m}{m+1000}}{M}$mol/L=$\frac{1000ρm}{(m+1000)M}$mol/L,故答案为:$\frac{1000ρm}{(m+1000)M}$.
(5)所得溶液的物质的量浓度=$\frac{\frac{m}{M}mol}{VL}$=$\frac{m}{MV}$mol/L,故答案为:$\frac{m}{MV}$.
点评 本题考查常用化学计量的计算等,难度不大,注意对公式的理解与灵活运用.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 37gNH4F和16gCH4中含有的共价键数均为4NA | |
| B. | 0.51.4mol•L-1的NaHSO3溶液中含有的SO32-数为2NA | |
| C. | 标准状况下,16.8LNO2完全溶于水,转移电子数为0.5NA | |
| D. | 高温高压和催化剂条件下,密闭容器中2gH2与足量N2反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+):②>④>③>① | B. | pH:②>③>④>① | ||
| C. | c(H+):①>③>②>④ | D. | c(NH3•H2O):②>④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
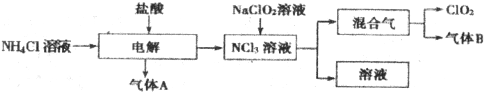
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.1 | 0.15 | 0.05 | - |
| Ⅱ | 607 | 0.2 | 0.3 | - | |
| Ⅲ | 627 | 0.1 | 0.15 | - | 6×10-2 |
| A. | 该反应为吸热反应 | |
| B. | 607K时,该反应的平衡常数为0.50 | |
| C. | 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol.L-1 | |
| D. | 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com