
【题目】在恒温、恒容条件下使N2(g)+3H2(g)![]() 2NH3(g)达到平衡,不能判断该反应已达到化学平衡的是
2NH3(g)达到平衡,不能判断该反应已达到化学平衡的是
A. v正(NH3)=2v逆(N2)
B. 密闭容器中混合气体的密度不变
C. 密闭容器中总压强不变
D. 密闭容器中氨气的体积分数不变
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】(1)工业上用_______和_______为原料制取漂白粉,有效成份是_______,制备原理是______________________(方程式表示)。漂白粉用于漂白的时候,最好与稀盐酸反应,有关化学方程式为______________________________________。
(2)Ca元素在周期表中的位置是__,Ca与最活泼的非金属元素A形成化合物D,D的电子式为___,HCl的沸点比A与H形成的化合物HA的沸点__(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A是一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应的火焰均呈黄色。

填写下列空白:
(1)写出化学式:A_____,B_____,D______________。
(2)以上反应中属于氧化还原反应的有_____(填序号)。
(3)写出反应⑤的离子方程式:___。写出反应⑥的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是
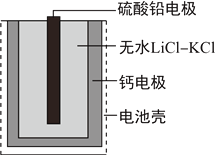
A. 放电时,电子由Ca电极流出
B. 放电过程中,Li+向PbSO4电极移动
C. 每转移0.2mol电子,理论上生成20.7 g Pb
D. 负极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)

A. C1上发生还原反应
B. Cu电极与C2电极上的电极反应相同
C. M 装置中SO42-移向Cu电极
D. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酸雨的说法不正确的是( )
A. 空气中的SO2溶于水,最终形成酸雨
B. NO2或SO2都会导致酸雨的形成
C. pH<7的雨水不都是酸雨
D. 工业废水任意排放是造成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用电化学原理,回答下列问题:
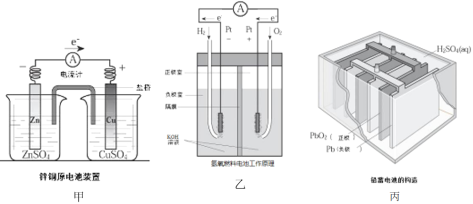
(1)上述三个装置中,负极反应物化学性质上的共同特点是_________。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________。
(3)乙中正极反应式为________;若将H2换成CH4,则负极反应式为_______。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验ⅰ中银作______极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用正催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大容器内的压强
A.②③B.②③④⑥C.②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ.(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1_____________________,t3_____________________,t4_____________________。
(2)下列时间段中,氨的百分含量最高的是(_______)
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com