
 .
. 分析 第三周期元素,元素的金属性越强,其单质置换出酸中氢能力越强;稀有气体化学性质最稳定;元素的非金属性越强,其最高价氧化物的水化物酸性越强;元素的金属性越强,其最高价氧化物的水化物碱性越强;氢氧化铝呈两性;氢氧化铝与盐酸、氢氧化钠反应生成盐和水;同一周期元素,原子半径随着原子序数增大而减小;离子电子层数越多其半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:第三周期元素,元素的金属性越强,其单质置换出酸中氢能力越强,金属性最强的是Na,则置换出氢能力最强的是Na元素;稀有气体化学性质最稳定,为Ar;元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性最强的是Cl元素,则最高价氧化物的水化物酸性最强的是 HClO4;
元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性最强的是Na,则最高价氧化物的水化物碱性最强的是NaOH; Al(OH)3呈两性;
氢氧化铝与盐酸、氢氧化钠反应生成盐和水,离子方程式分别为Al(OH)3+3H+=Al3++3H2O、
Al(OH)3+OH-=AlO2-+2H2O;同一周期元素,原子半径随着原子序数增大而减小,所以原子半径最大的是钠;离子电子层数越多其半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,离子半径最小的是铝离子,离子结构示意图为 ,
,
故答案为:Na;Ar;HClO4;NaOH; Al(OH)3; Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;钠; .
.
点评 本题考查同一周期元素性质递变规律,侧重考查原子结构及其性质,明确元素金属性、非金属性、最高价氧化物的水化物酸碱性关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:填空题
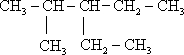 ;
;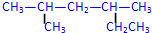 2,4-二甲基己烷
2,4-二甲基己烷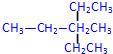 3-甲基-3-乙基戊烷
3-甲基-3-乙基戊烷 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O.
+2H2O.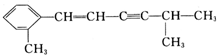 该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | Na2S溶液中滴加NClO溶液:S2-+ClO-+H2O═S↓+Cl-+2OH- | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属被腐蚀的本质是M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 对某些工具的“机械转动部位”选用刷油漆的方法来防锈 | |
| C. | 金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀 | |
| D. | 常温下,置于空气中的金属主要发生化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
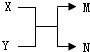
| A. | 若X为Fe,N为氢气,则Y一定为酸 | |
| B. | 若X、N为化合物,Y为水,则M一定是气体单质 | |
| C. | 若X、Y、M、N均为化合物,该反应一定属于复分解反应 | |
| D. | 若X、Y、M、N均为10电子微粒,且M是工业生产HNO3的一种原料气,则N常温下一定呈液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池中电子流出的一极是正极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,电子有负极向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
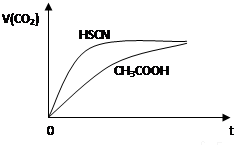
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煮饭前米用水洗一洗 | B. | 冰箱中放入木炭后,异味消失 | ||
| C. | 自行车轮胎在烈日下爆裂 | D. | 食物变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C10H14 | B. | C11H16 | C. | C12H18 | D. | C13H20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com