
 2SO3(g) △H<0 反应来说:
2SO3(g) △H<0 反应来说: 2SO3(g),可以得到
2SO3(g),可以得到 2SO3(g) △H<0,即该反应为放热反应,所以降低温度能使平衡常数K增大,故本题的答案选B;增大压强和移出生成的SO3都不能改变平衡常数;
2SO3(g) △H<0,即该反应为放热反应,所以降低温度能使平衡常数K增大,故本题的答案选B;增大压强和移出生成的SO3都不能改变平衡常数; 2SO3(g),当容器内压强保持不变,v(SO2)逆 =" 2" v(O2)正该反应达到平衡,所以本题的答案选择BC,SO2的转化率和O2的转化率相等在反应的任何时候都是如此,不能用来判断反应是否达到平衡,故A错误,容器内密度保持不变,因为反应的容器的体积不变,所以在反应的任何时候都是如此,不能用来判断反应是否达到平衡,故D错误;
2SO3(g),当容器内压强保持不变,v(SO2)逆 =" 2" v(O2)正该反应达到平衡,所以本题的答案选择BC,SO2的转化率和O2的转化率相等在反应的任何时候都是如此,不能用来判断反应是否达到平衡,故A错误,容器内密度保持不变,因为反应的容器的体积不变,所以在反应的任何时候都是如此,不能用来判断反应是否达到平衡,故D错误;

科目:高中化学 来源:不详 题型:单选题
 4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )| A.v(O2)=0.01mol/(L?s) | B.v(NO)=0.01mol/(L?s) |
| C.v(H2O)=0.006mol/(L?s) | D.v(NH3)=0.005mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
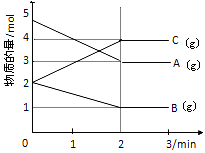
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )
2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )| A.0.2mol/L·S | B.0.4mol/L·S |
| C.0.6mol/L·S | D.0.8mol/L·S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率可用某时刻生成物的物质的量来表示 |
| B.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加 |
| C.对于任何化学反应来说,反应速率越快,反应现象就越明显 |
| D.根据反应速率的大小可知化学反应进行的相对快慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入10mL 3mol·L-1盐酸 |
| B.给反应混合物加热 |
| C.将所用的大理石研磨成粉末 |
| D.加入10mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2 C(g),一小时后反应达到平衡,若此时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为 ,B在的反应速率 ,平衡时C的体积分数为_______。
2 C(g),一小时后反应达到平衡,若此时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为 ,B在的反应速率 ,平衡时C的体积分数为_______。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com