
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
分析 (1)根据达到平衡状态的特征:各组分浓度不再变化,正逆反应速率相等进行判断;
(2)25℃下达到分解平衡.若在恒温下压缩容器体积,则压强增大,平衡逆向移动;
(3)温度升高,平衡气体总浓度增大;△S是物质的混乱程度的,氨基甲酸铵分解反应固体变成气体.
解答 解:(1)A、没有标明正逆反应速率,无法判断平衡状态,故A错误;
B、由于反应前后气体的化学计量数之和不相等,压强不变,达到了平衡状态,故B正确;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故正确;
D、氨气体积分数不变,不能说明正逆反应速率相等,各组分浓度不变,故D错误;
故选BC;
(2)压缩容器体积,增大了压强,平衡向着逆向移动,氨基甲酸铵固体的质量增加,故答案为:增加;
(3)温度升高,平衡气体总浓度增大,平衡正向移动,正反应是吸热反应,所以△H>0,氨基甲酸铵分解反应是固体变成气体,混乱程度变大,△S>0,
故答案为:>;>.
点评 本题考查了化学平衡状态的判断,注重了基础知识的考查,学生只要掌握平衡状态的标志就可以迅速解题了,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(H+)随温度的升高而降低 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 溶液pH:pH(35℃)>pH(25℃) | |
| D. | 35℃时已电离的水的浓度约为1.45×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验装置 | 现象 |
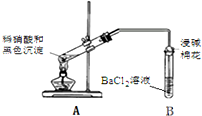 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
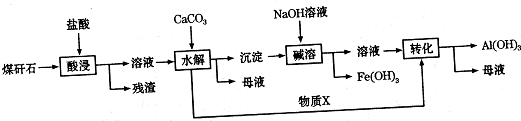
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
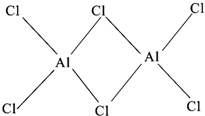 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干水属于有机合成材料 | |
| B. | 干水中的水分子停止运动 | |
| C. | 干水是一种混合物 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com