
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在如图装置中进行实验,向a中加入0.5mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
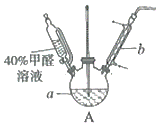
①仪器a的名称是__,仪器b的作用为__。
②能说明甲醛具有还原性的实验现象是__。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物含H2不含CO,将装置A和如图所示的装置连接后进行实验。
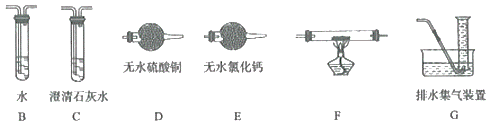
①依次连接的合理顺序为A→B→___→____→___→___→G;___
②装置B的作用是___;
③确认气体产物中含H2而不含CO的现象是___。
(3)已知:![]()
![]()
![]()
![]()
![]() 。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
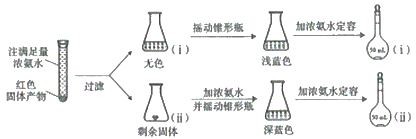
已知:i:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)。
[Cu(NH3)4]2+(蓝色)。
ⅱ:2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___。
【答案】三颈瓶 冷凝回流 A中出现红色物质(或A中出现棕色物质) E→F→D→C 吸收甲醛蒸气,防止其干扰后续检验 C中澄清石灰水不变浑浊,D中无水硫酸铜变蓝 滴入过量的浓盐酸,未见气泡产生 n(Cu2O):n(Cu)=l:200
【解析】
(1)①根据仪器的结构和性能确定仪器a的名称;仪器b为球形冷凝管;
②甲醛具有还原性,和新制氢氧化铜加热反应生成氧化亚铜红色沉淀;
(2)为确认气体产物中含H2不含CO,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体。据此设计实验验证;
(4)反应现象和元素守恒得到固体物质组成为氧化亚铜和铜,将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近说明浓度相同。
(1)①仪器a的名称是三颈瓶,仪器b为球形冷凝管,主要是冷凝回流反应物;
②能说明甲醛具有还原性的实验现象是和新制氢氧化铜加热反应生成氧化亚铜红色沉淀A中出现红色物质(或A中出现棕色物质),故答案为:A中出现红色物质(或A中出现棕色物质);
(2)①为确认气体产物中含H2不含CO,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体,依次连接的合理顺序为ABEFDCG;
②装置B的作用是吸收甲醛蒸气,防止其干扰后续检验;
③当观察到C中澄清石灰水不变浑浊,D中无水硫酸铜变蓝,即可确认气体产物中含H2而不含CO;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体,设计实验证明a中甲醛的碳元素未被氧化成+4价的方法为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;
(4)将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近,说明[Cu(NH3)4]2+浓度相同,根据铜元素守恒可知,固体产物的组成及物质的量之比约为n(Cu2O):n(Cu)=1:200。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】关于可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)及其图象的说法正确的是( )
pC(g)+qD(g)及其图象的说法正确的是( )
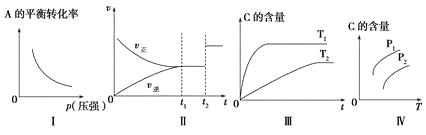
A.若图象为Ⅰ,则m+n>p+q
B.若图象为Ⅱ,则m+n=p+q,t2时刻改变的条件一定是使用催化剂
C.若图象为Ⅲ,则该可逆反应的ΔH<0
D.若图象为Ⅳ,且压强p1>压强p2,则该可逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 molL﹣1 HA溶液中逐滴加入0.02 molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是

A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 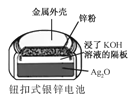 正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D. 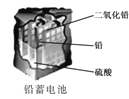 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
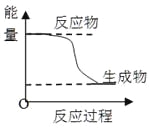
A.化学平衡发生移动,平衡常数不一定发生变化
B.升高温度会增大化学反应速率,原因是增加了活化分子的百分数
C.某化学反应的能量变化如上图所示,则该反应的△H>0,△S>0
D.H3PO4的电离常数:K1>>K2>>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一般采用700 K左右的温度,其原因是( )
2NH3(g) ΔH=-92.4 kJ·mol-1一般采用700 K左右的温度,其原因是( )
①提高H2的转化率 ②适当提高氨的合成速率 ③提高氨的产率 ④催化剂在700 K时活性最大
A.只有①B.②④C.②③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则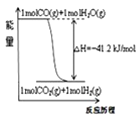 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.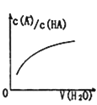 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是有机化学中的几个重要实验。图一是制取乙酸乙酯,图二是验证醋酸、碳酸、苯酚酸性强弱;图三是实验室制取乙炔并检验其部分性质。请根据要求填空。
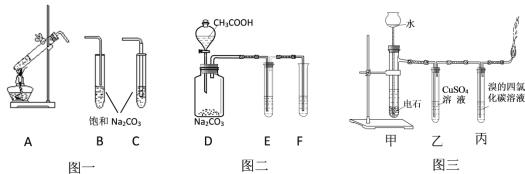
(1)图一中A发生的化学方程式为__________, A的导管应与_______相连(填字母)。
(2)图二中的E和F分别盛装的药品应为_____________和______________。
A.石蕊溶液 B.苯酚钠溶液 C.碳酸氢钠溶液 D.碳酸钠溶液
(3)图三中乙装置的作用是_______________,实验过程中发现燃烧非常剧烈,分析其主要原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com