
有一包白色粉末,其中可能含有Ba(NO3)2、MgCl2、K2CO3、NaOH,现做以下实验:
①取一定量粉末加入水中,振荡,有白色沉淀生成;
②向①的沉淀物中加入足量稀硝酸,白色沉淀完全消失,没有气泡产生;
③向①的上层清液中滴入稀硫酸,有白色沉淀产生。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是_________,一定不含有的物质是________。(写化学式)
(2)写出各步变化的离子方程式
①________________________________________________________________;
②________________________________________________________________;
③________________________________________________________________。
【解析】由实验②知原白色粉末无K2CO3,则实验①中的反应是MgCl2+2NaOH
====Mg(OH)2↓+2NaCl,该反应的离子方程式是Mg2++2OH-====Mg(OH)2↓;实验②中沉淀溶解的化学方程式是Mg(OH)2+2HNO3====Mg(NO3)2+2H2O,离子方程式是Mg(OH)2+2H+====Mg2++2H2O;实验③说明原粉末中含Ba(NO3)2,发生反应的化学方程式是Ba(NO3)2+H2SO4====BaSO4↓+2HNO3,离子方程式是Ba2++S ====BaSO4↓。
====BaSO4↓。
答案:(1)Ba(NO3)2、MgCl2、NaOH K2CO3
(2)①Mg2++2OH-====Mg(OH)2↓
②Mg(OH)2+2H+====Mg2++2H2O
③Ba2++S ====BaSO4↓
====BaSO4↓


科目:高中化学 来源: 题型:
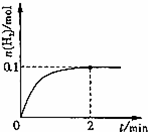
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)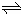 H2(g)+I2(g)反应, H2物质的量随时间的变化如上图所示.0~2min内的平均反应速率v(HI)=__________; 该温度下,H2(g)+I2(g)
H2(g)+I2(g)反应, H2物质的量随时间的变化如上图所示.0~2min内的平均反应速率v(HI)=__________; 该温度下,H2(g)+I2(g)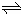 2HI(g)的平衡常数K=__________相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则__________是原来的2倍.(填序号)
2HI(g)的平衡常数K=__________相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则__________是原来的2倍.(填序号)
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡__________移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的__________,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
将一小块钠投入盛50 mL澄清饱和石灰水的烧杯里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动 B.有气体生成
C.溶液底部有银白色物质生成 D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5 nm~36 nm(1 nm=10-9m)的磁流体。下列说法正确的是( )
A.所得的分散系属于溶液
B.所得的分散系能产生丁达尔效应
C.所得的分散系不能通过滤纸
D.分子直径比Fe2+小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应,最终一定能得到白色沉淀的是( )
A.向Na2CO3溶液加入CaCl2溶液
B.向CuSO4溶液中加入NaOH溶液
C.向FeCl2溶液中加入过量NaOH溶液
D.向Al2(SO4)3溶液中加入过量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A、热化学方程式的计量数可以表示分子的个数
B、热化学方程式中只需标明生成物的状态
C、反应热指的是反应过程中放出或吸收的热量
D、伴随能量变化的一定是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用的浓盐酸密度为1.17 g·mL-1,物质的量浓度为11.7mol/L,
(1)取此浓盐酸50 mL,用蒸馏水稀释至200 mL后稀盐酸的物质的量浓度?
(2)将13 g锌投入上述实验所得稀盐酸中,充分反应,
求:放出的H2在标准状况下的体积;
(3)此浓盐酸中HCl的质量分数?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com