
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O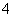 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是( )
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O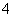 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于常温下,pH=2的醋酸溶液的叙述正确的是( )
A.c(CH3COOH)=0.01 mol/L
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,pH=4
D.加入醋酸铵固体,可抑制醋酸的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100 mL 3 mol/L的NaOH溶液吸收标准状况下4.48 L CO2时,所得溶液中各离子浓度由大到小的顺序为______________________________________________。
(2)常温下,向一定体积的0.1 mol/L的醋酸溶液中加水稀释后,下列说法正确的是________。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中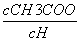 减小
减小
(3)①常温下将0.15 mol/L的稀硫酸V1 mL与0.1 mol/L的NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=__________(溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是__________。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是__________。
A.HCN B.HClO
C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
D.NaHCO3+HCN===NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10
10C+P4O10===P4(白磷)+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O===□Ce(OH)4↓+□________。
解析:(1)反应过程中磷酸钙最终变成了白磷,磷的化合价由+5价变成0价,由此可以得到 如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
(2)分析反应可知,C e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据有机化合物的命名原则,下列命名正确的是( )
A. 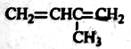 3-甲基-1,3-丁二烯 B.
3-甲基-1,3-丁二烯 B.  2-羟基丁烷
2-羟基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 D.CH3CH(NH2)CH2COOH 3-氨基丁酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com