
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大H2浓度 | D. | 减小压强 |
分析 要想使容器内气体的颜色加深,就需要加大Br2的浓度,加大Br2浓度的方法结合选项有两种:一是升高温度,反应向吸热的方向移动,Br2浓度增大,颜色加深;二是减小容器的体积即加大容器的压强,由于反应前后计量数相等,压强变化不会带来平衡的移动,但体积减小,Br2浓度增大,颜色加深,催化剂不改变化学平衡.
解答 解:A.升高温度,化学平衡性质逆向移动,c(Br2)增大,混合气体的颜色加深,故A正确;
B.催化剂改变反应速率不改变化学平衡,混合气体颜色不变,故B错误;
C.增大氢气浓度,平衡正向进行,溴单质浓度减小,混合气体的颜色变浅,故C错误;
D.减小压强平衡不移动,但体积增大,c(Br2)减小,混合气体的颜色变浅,故D错误;
故选A.
点评 本题考查影响化学平衡的因素,题目难度不大,注意掌握化学平衡的影响因素,明确反应达到平衡后,欲使颜色加深,必须使c(Br2)增大,根据化学平衡移动原理进行判断即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
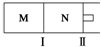 M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| B. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| C. | 若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.4mol A时,v正>v逆 | |
| D. | 起始时,分别向M、N两个容器中加入1molA和1molC,达到平衡时,容器M、N中物质A的体积分数:M<N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=2 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=3:2 | |
| D. | 向电解后的溶液中先后加入16 g CuO和3.6g水,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,MnO2是负极 | |
| B. | 电解质是KOH溶液 | |
| C. | 锌发生氧化反应,MnO2发生还原反应 | |
| D. | 它的能量和储存时间比普通锌锰电池高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银 | |
| B. | 甲池通入 CH3OH 的电极反应式为 CH3OH+6e-+2H2O═CO32-+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4溶液恢复到 原浓度 | |
| D. | 甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 同温同压下,两种气体的体积之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的密度之比为17:16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com