
| 族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
 .
. ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.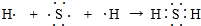 .
. 分析 由元素在周期表中位置,可知A为氢,B为碳,C为氧,D为Na,E为Mg,F为Al,G为硫,H为Cl,I为Ar,K为钾,J为Ca.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)同周期自左而右原子半径减小;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;非金属性越强,单质的氧化性越强;
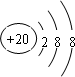
(3)J的简单离子为Ca2+,离子核外电子数为18,结合核外电子排布规律画出结构示意图;
(4)金属性越强,最高价氧化物对应水化物的碱性越强;
(5)非金属越强,最高价氧化物对应水化物的酸性越强,氢化物越稳定;
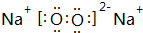
(6)C和D的单质在点燃条件下生成化合物为Na2O2,由钠离子与过氧根离子构成;
(7)A和G所形成的简单化合物为H2S,属于共价化合物,用S原子、H原子电子式表示其形成过程.
解答 解:由元素在周期表中位置,可知A为氢,B为碳,C为氧,D为Na,E为Mg,F为Al,G为硫,H为Cl,I为Ar,K为钾,J为Ca.
(1)稀有气体原子最外层为稳定结构,Ar化学性质最不活泼;同周期自左而右金属性减弱,同主族自上而下金属性增强,故K的金属性最强,
故答案为:Ar;K;
(2)同周期自左而右原子半径减小,故第三周期中Na原子半径最大;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,离子半径最小为Al3+;Cl的非金属性最强,非金属性越强,单质的氧化性越强,
故答案为:Na;Al;Cl;
(3)J的简单离子为Ca2+,离子核外电子数为18,离子结构示意图为: ,
,
故答案为: ;
;
(4)同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,按碱性依次减弱顺序排列为:KOH>NaOH>Mg(OH)2>Al(OH)3,
故答案为:KOH>NaOH>Mg(OH)2>Al(OH)3;
(5)非金属性Cl>S,故酸性HClO4>H2SO4,氢化物稳定性:HCl>H2S,
故答案为:HClO4>H2SO4;HCl>H2S;
(6)C和D的单质在点燃条件下生成化合物为Na2O2,电子式为 ,属于离子化合物,
,属于离子化合物,
故答案为: ;离子化合物;
;离子化合物;
(7)A和G所形成的简单化合物为H2S,属于共价化合物,用S原子、H原子电子式表示其形成过程: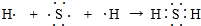 ,
,
故答案为: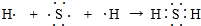 .
.
点评 本题考查元素周期表与元素周期律的综合运用,侧重对化学用语与元素周期律的考查,熟练掌握前四周期元素,难度不大.


科目:高中化学 来源: 题型:解答题
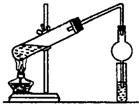 某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.
某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
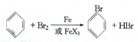
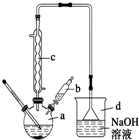 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5s | B. | 等于10s | C. | 小于10s | D. | 大于10s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 | |
| D. | 用高锰酸钾溶液除去乙烷中的乙烯杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8N4 | B. | C6H12N4 | C. | C6H10N4 | D. | C4H10N4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com