
|
海水提镁的最后一步是将氯化镁电解制取镁,下列有关该电解过程的叙述正确的是 | |
A. |
两个电极必须用惰性电极 |
B. |
阳极必须用惰性电极,阴极则可以用非惰性电极 |
C. |
电极熔融状态的氯化镁 |
D. |
电解氯化镁的水溶液 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:阅读理解
我国有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。镁因其合金性能卓越,在汽车、飞机制造方面很重要,有“国防金属”之称。发达国家多数从海洋中提镁,中国海水提镁技术也在不断进步。海水中虽含镁离子很多,但它是很分散的(1.28 g?L-1),要提取镁首先应让镁离子与其它离子等分离。
请回答下列问题:
(1)某化学兴趣小组利用煅烧海边贝壳所得产物,投入浓缩的海水中,最终变成了Mg(OH)2浊液。请写出最后一步反应的离子方程式: 。
(2)已知,氧化镁熔点2852℃,氯化镁的熔点714℃。无水氯化镁是工业制取镁的原料。试写出实验室蒸发氯化镁溶液制取无水氯化镁必需的实验仪器是 ;某同学对蒸发得到的固体,用酒精喷灯加热却不能熔化,请你试分析原因

(3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 。
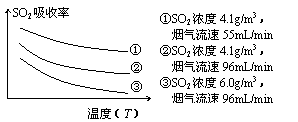 ②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com