
【题目】Ⅰ. 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成Hb·CO,使血红蛋白失去输送 O2功能。CO进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:______。
(2)抽烟时,进入肺部的空气中c(CO)=10-6mol·L-1,c(O2)=10-2mol·L-1,则c(Hb·CO)为c(Hb·O2)的___________倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与c(CO)的比值应大于_____。
Ⅱ.在某一温度条件下, Bodensteins 研究了反应:2HI(g)![]() H2(g) +I2(g),气体混合物中 HI 的物质的量浓度x(HI)(mol·L-1)与反应时间t的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度x(HI)(mol·L-1)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20 min,v正=___________。
【答案】在高压氧舱中,煤气中毒患者吸入氧气浓度较高的空气后,CO+Hb·O2![]() O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能 0.022 11000 K=0.1082/0.7842
O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能 0.022 11000 K=0.1082/0.7842 ![]() 1.62×10-3
1.62×10-3
【解析】
根据平衡移动原理及平衡常数表达式分析解答。
(1)在高压氧舱中,煤气中毒患者吸入氧气浓度较高的空气后,CO+Hb·O2![]() O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能,故答案为:在高压氧舱中,煤气中毒患者吸入氧气浓度较高的空气后,CO+Hb·O2
O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能,故答案为:在高压氧舱中,煤气中毒患者吸入氧气浓度较高的空气后,CO+Hb·O2![]() O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能;
O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能;
(2)将c(CO)、c(CO2)代入平衡常数表达式,K=![]() ,解得
,解得![]() =0.022,故答案为:0.022;
=0.022,故答案为:0.022;
(3)根据化学平衡常数表达式:K=![]() ,
,![]() ,
,![]() ,即大于11000时,人的智力受损失,故答案为:11000;
,即大于11000时,人的智力受损失,故答案为:11000;
(4)120 min时达到平衡,根据第一次实验,c(HI)=0.784 mol·L-1,c(H2)=c(I2)=![]() =0.108 mol·L-1,K=
=0.108 mol·L-1,K=![]() ,故答案为:
,故答案为:![]() ;
;
(5) 达到平衡,v正=v逆,k正x2(HI)=k逆x(H2)x(I2),k逆=![]() ;将x(HI)=0.9,k正=0.002,代入公式,v正=1.62×10-3,故答案为:
;将x(HI)=0.9,k正=0.002,代入公式,v正=1.62×10-3,故答案为:![]() ;1.62×10-3。
;1.62×10-3。


科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,在含4克NaOH溶质的溶液中通入一定量的CO2,将溶液蒸干并灼烧,最后得到的固体是
A.0.1NA的NaHCO3
B.0.05NA Na2CO3
C.0.05NA~0.1NA Na2CO3和NaHCO3混合物
D.0.1NA的NaHCO3和NaOH混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Cr2(SO4)3的水溶液中加入Na0H溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-),其平衡关系为:![]()
向50mL0.05mol/L的Cr2(SO4)3溶液中,加入l.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A. 溶液为紫色 B. 溶液中有灰绿色沉淀 C. 溶液为亮绿色 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家罗伯特莱夫科维茨和布莱恩克比尔卡因“G 蛋白偶联受体研究”而获得2012年诺贝尔化学奖,他们将碘的同位素附着到各种激素上,借助放射学找到一些受体,进一步研究出“G 蛋白偶联受体”发挥的作用和机理,下列有关说法正确的是( )
A.放射性同位素![]() I 原子核内中子数与质子数的差为 78
I 原子核内中子数与质子数的差为 78
B.蛋白质是生物体维持生命活动所需能量的主要来源
C.动物蛋白质和植物蛋白质混合摄入,更能增强蛋白质的营养作用
D.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是工业上主要用作有机合成的原料溶剂,可由最简单芳香烃A经如图流程制得:
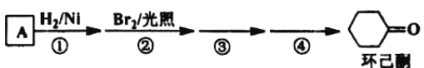
回答下列问题:
(1)反应①的反应类型为___反应,③的反应类型为___。
(2)反应④所用的试剂为___。
(3)A的同系物(C8H10)所有可能的结构简式为___。
(4)环己酮的还原产物能与乙酸产生乙酸乙酯,请写出产生酯的条件:___。
(5)写出A的相邻同系物合成![]() 的合成路线___。
的合成路线___。
合成路线的常用表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取m g AgNO3固体粉末充分加热,得到a L气体和b g 固体。将气体用足量的水吸收,剩余气体的体积为c L(气体体积均为同温同压下测定)。下列结论一定正确的是
A.aL气体的平均相对分子质量为30.67
B.aL气体被水吸收时转移电子的物质的量为(![]() )mol
)mol
C.cL剩余气体是O2,且c= ![]()
D.将m g AgNO3溶于水,再加足量的盐酸,可生成沉淀![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
(1)该反应中被氧化是元素是_________;写出该反应的平衡常数表达式:K=_________。增大NO2浓度,平衡常数K_________。(填“增大”、“减小”或“不变”)
(2)若上述反应在密闭容器中进行,能表明反应达到平衡状态的是_________(选填编号)。
a. 混合气体颜色保持不变 b. NO2和NO的体积比保持不变
c. 每消耗1 mol SO2的同时生成1 mol SO3 d. 体系中气体平均摩尔质量保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO2)=_________(用相关字母表示)。
(4)请写出两种能提高平衡转化率的措施____________、______________。
(5)其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选择Fe2O3作催化剂的主要原因是___________
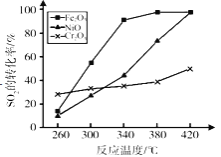
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com