

(1)①烧瓶中发生反应的化学方程式是;②装置B和C的作用是__________________;③烧瓶要干燥放入电石后应塞紧橡皮塞,这是为了_________________________________;④容器A中弯曲的导管的作用是__________________________________________________________。
(2)①所用的电石质量不能太大,否则____________;也不能太小,否则 ____________;
②若容器B的容积为250 mL,则所用的电石质量应为_________g左右(选填0.30、0.60、1.00、1.50、2.00)。
(3)实验室能否用启普发生器制乙炔?_________。其原因是 ________________________。
(4)为了得到比较平衡的乙炔气流,常可用_________代替水。
(5)实验中测得排入量筒中的水的体积有V mL(1.01×105 Pa,0 ℃),电石质量为W g,则电石中碳化钙的质量分数是_________ (不计导管中残留的水,气体中饱和水蒸气也忽略不计)。
解析:由于气瓶内的容积有限,所以应通过CaC2—C2H2的容量关系粗略估计CaC2的用量:
CaC2—C2H2
64 g 1 mol
x ![]()
所以x=0.71 g
电石质量应在0.60 g左右。
答案:(1)CaC2+2H2O![]() Ca(OH)2+CH≡CH↑ B贮水,以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒C,由此可测定生成乙炔的量 防止电石与残留水作用,同时防止产生的C2H2气体逸失到大气中 便于液体顺利滴加
Ca(OH)2+CH≡CH↑ B贮水,以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒C,由此可测定生成乙炔的量 防止电石与残留水作用,同时防止产生的C2H2气体逸失到大气中 便于液体顺利滴加
(2)生成C2H2气体太多,超过B的容积,无法测定其体积
生成C2H2气体太小,测定误差大 0.60
(3)不能 反应速率快,放出大量热生成,Ca(OH)2悬浊液堵塞导管
(4)饱和食盐水 (5)![]()


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:四中大考卷 高二化学(下册)、期中测试卷 题型:058
某同学设计如下图所示的实验装置来粗略测定电石中碳化钙的质量分数.
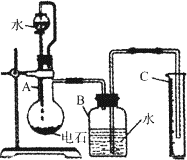
(1)烧瓶中发生反应的化学方程式是________.
(2)装置B和C的作用是________.
(3)所用的电石质量不能太大,否则________;也不能太小,否则________.若容器B的容积为250mL,则所用的电石质量应在________g左右(从以下数据选填:0.30、0.60、1.00、1.50、2.00)
(4)实验中测得排入量筒中水的体积为VmL(![]() Pa,25℃),电石质量为Wg,则电石中碳化钙的质量分数是________.(不计算导气管中残留的水;气体中饱和水蒸气也忽略不计.)
Pa,25℃),电石质量为Wg,则电石中碳化钙的质量分数是________.(不计算导气管中残留的水;气体中饱和水蒸气也忽略不计.)
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058

(1)烧瓶中发生反应的化学方程式是___________。装置B和C的作用是______________。烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了___________。容器A中弯曲的导管的作用是_______________。
(2)所用的电石质量不能太大,否则___________;也不能太小,否则___________。若容器B的容积为250 mL,则所用的电石质量应在___________g左右(从以下数据选填:0.30、0.60、1.00、1.50、2.00),(气体体积以标准状况计)。
(3)实验室能否用启普发生器制乙炔___________(“能”或“不能”)。
(4)实验中测得排入量筒中水的体积为V mL(以标准状况计),电石质量为W g。则电石中碳化钙的质量分数是_________(不计算导管中残留的水;气体中饱和水蒸气也忽略不计)。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058

(1)烧瓶中发生反应的化学方程式是___________。装置B和C的作用是______________。烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了___________。容器A中弯曲的导管的作用是_______________。
(2)所用的电石质量不能太大,否则___________;也不能太小,否则___________。若容器B的容积为250 mL,则所用的电石质量应在___________g左右(从以下数据选填:0.30、0.60、1.00、1.50、2.00),(气体体积以标准状况计)。
(3)实验室能否用启普发生器制乙炔___________(“能”或“不能”)。
(4)实验中测得排入量筒中水的体积为V mL(以标准状况计),电石质量为W g。则电石中碳化钙的质量分数是_________(不计算导管中残留的水;气体中饱和水蒸气也忽略不计)。
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第15期 总第171期 人教课标版(选修4) 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com