
【题目】硼氢化钠(NaBH4)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为33 ℃)。工业上可用硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如下:
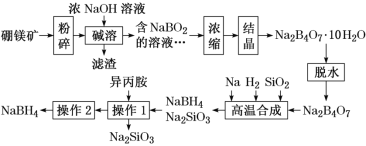
回答下列问题:
(1)NaBH4中氢元素的化合价为_______。
(2)碱溶时Mg2B2O5发生反应的化学方程式是________。
(3)滤渣的主要成分是_____。
(4)高温合成中,加料之前需将反应器加热至100 ℃以上,并通入氩气。通入氩气的目的是_____。
(5)操作2的名称为______,流程中可循环利用的物质是_____。
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,电解总反应的离子方程式为_______。

(7)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 g NaBH4的还原能力相当于_____g H2的还原能力(结果保留两位小数)。
【答案】-1 Mg2B2O5+2NaOH+H2O = 2NaBO2+2Mg(OH)2或Mg2B2O5·H2O+2NaOH = 2NaBO2+2Mg(OH)2 Fe3O4和Mg(OH)2 排除装置中的水蒸气和空气 蒸馏 异丙胺 ![]() +2H2O
+2H2O![]()
![]() +2O2↑ 0.21
+2O2↑ 0.21
【解析】
硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)中的Fe3O4不能溶于NaOH,过滤后形成滤渣,得到的NaBO2溶于经过浓缩结晶得到Na2B4O7·10H2O,脱水后生成Na2B4O7,Na2B4O7在钠和氢气条件下与二氧化硅反应生成NaBH4和硅酸钠,用异丙胺溶解生成的NaBH4,除去硅酸钠,如何通过蒸馏分离得到NaBH4,据此分析解答。
(1)NaBH4中Na为+1价、B为+3价,根据化合物中各元素正负化合价代数和为0,计算出H为-1价,故答案为:-1价;
(2)碱溶时Mg2B2O5发生反应的化学方程式为Mg2B2O5+2NaOH+H2O = 2NaBO2+2Mg(OH)2,故答案为:Mg2B2O5+2NaOH+H2O = 2NaBO2+2Mg(OH)2;
(3)根据上述分析,滤渣的主要成分是Fe3O4和Mg(OH)2,故答案为:Fe3O4和Mg(OH)2;
(4)反应加料之前,需要将反应容器加热至100℃以上并通入氩气,氩气可以排出反应器中的水蒸气和空气,防止氢气和钠以及生产的硼氢化钠(NaBH4)与氧气和水反应,故答案为:排出反应器中的水蒸气和空气;
(5)操作1得到的物质是硼氢化钠和异丙胺的混合物,异丙胺的沸点为33 ℃,较低,易挥发,可以通过蒸馏操作分离二者,因此操作2为蒸馏,分离得到的异丙胺可循环利用,故答案为:蒸馏;异丙胺;
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,根据图示,NaBO2在阴极发生还原反应生成![]() ,阳极上水发生氧化反应放出氧气,电解的总反应的离子方程式为
,阳极上水发生氧化反应放出氧气,电解的总反应的离子方程式为![]() +2H2O
+2H2O![]()
![]() +2O2↑,故答案为:
+2O2↑,故答案为:![]() +2H2O
+2H2O![]()
![]() +2O2↑;
+2O2↑;
(7) NaBH4中H为-1价,做还原剂时,H从-1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,即38g NaBH4转移8mol电子,则1 g NaBH4转移电子数为8mol×![]() =
=![]() mol,H2做还原剂,1molH2失去电子2mol,则转移
mol,H2做还原剂,1molH2失去电子2mol,则转移![]() mol电子需要氢气
mol电子需要氢气![]() mol,质量为
mol,质量为![]() mol×2g/mol=0.21g,故答案为:0.21。
mol×2g/mol=0.21g,故答案为:0.21。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。将混合气体依次通过如图装置,最后收集在气球中。下列结论不正确的是( )
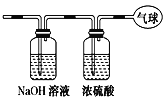
A.原混合气体所含氧原子总数为0.6 NA(用NA表示阿伏加德罗常数的值)
B.标况下气球中收集到的气体体积为4.48L
C.原混合气体的平均摩尔质量为32g/mol
D.原混合气体CO和CO2的体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是极易溶于水的气体,常温常压下,1体积水大约能溶解700体积的氨气。
(1)实验室可在浓氨水中加入固体NaOH快速制取氨气,请用化学平衡移动原理简述原因_______________________________________________________________。
(2)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比________(填“>”、“<”或“=”)10。
(3)向10mL0.1 mol/L的氨水中逐滴加入20mL 0.1 mol/L的醋酸,溶液导电性的变化是__________________(填“增大”、“减小”或“不变”)。写出二者反应的离子方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下,对于反应:A(g)+3B(g)![]() 3C(g),达到平衡状态的标志是( )
3C(g),达到平衡状态的标志是( )
A.v正(A)=3v逆(C)
B.密闭容器内气体的密度不再改变
C.单位时间内消耗3nmolC的同时,生成3n molB
D.密闭容器内A、B、C气体的浓度之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质制取的化学方程式中,不属于氧化还原反应的是( )
A.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑
B.实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑
C.实验室制取氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.工业上制取二氧化氯:2NaClO3+4HCl(浓)=2NaCl+2H2O+2ClO2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A. 新制氯水使红玫瑰变为白玫瑰,说明有Cl2
B. 加入石蕊溶液,溶液变红,说明该溶液一定不含HClO
C. 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D. 光照新制氯水有气泡逸出,该气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在用硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.还原剂是![]() 和
和![]() ,氧化剂是
,氧化剂是![]()
C.氧化产物是S,还原产物是![]() 和
和![]()
D.当转移![]() 时,有
时,有![]() 参加反应
参加反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com