
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物) 为原料制备Mg CO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为:
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O H = -50.4kJ·mol-1
Mg2SiO4(s) +4 H+(aq)=2 Mg2+(aq) +H2SiO3(s) + H2O(l) H =-225.4kJ··mol-1
向Mg2SiO4悬浊液中通入CO2析出H2SiO3的热化学方程式为__________,该反应能正向进行的热力学原因是_________。该反应的平衡常数表达式为__________。
(2)对氧化后的溶液,加入萃取剂磷酸二异辛酯(C16H35O4P)的煤油溶液,并调节pH为1.4~4.3,萃取剂的体积约为水溶液的0.5倍,充分振荡、静止、分层(上层为含三价铁的有机层),分液。向分液得到的有机层加硫酸反萃取得到硫酸铁溶液,从而与有机层分离。萃取反应为:Fe2(SO4)3(水层)+6HA(有机层)=2FeA3(有机层)+3H2SO4(水层)
①提高萃取效率的措施有__________。
A 适当提高萃取剂的浓度 B 适当提高溶液酸度
C 充分振荡,多次萃取 D 不断地从下层排除出有机层
②在反萃取中加硫酸的作用是___________。
(3)萃取后的水溶液制备Mg CO3·3H2O的实验方案:滴加氨水调节溶液的pH在一定范围内,过滤。向滤液中滴加Na2 CO3溶液,搅拌、静置、过滤,用水洗涤固体2~3次,在50℃下干燥,得到Mg CO3·3H2O。[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
①调节溶液pH的范围____________。
②判断向滤液中滴加Na2CO3溶液过量的方法__________。
(4)从废渣制备Mg CO3·3H2O的整体实验方案看,酸溶时所加H2SO4不宜过量太多的原因是_________。
【答案】Mg2SiO4(s)+2CO2(g)+H2O(l)= 2MgCO3(s)+H2SiO3(s)△H=-124.6kJmol-1 该反应放热(或△H <0)有利于正向进行 K=![]() AC 促进萃取平衡逆向移动,Fe3+进入水层 5.0≤ pH <8.5 向上层清液中继续滴加Na2CO3溶液 ,若无沉淀生成,证明Na2CO3过量(其他答案合理即可) 不利于Fe3+萃取,避免制备MgCO3时消耗更多的氨水
AC 促进萃取平衡逆向移动,Fe3+进入水层 5.0≤ pH <8.5 向上层清液中继续滴加Na2CO3溶液 ,若无沉淀生成,证明Na2CO3过量(其他答案合理即可) 不利于Fe3+萃取,避免制备MgCO3时消耗更多的氨水
【解析】
将废渣溶于硫酸,硅元素形成硅酸沉淀被过滤除去,用过氧化氢进行氧化,确保铁元素氧化成三价,通过萃取的形式除去三价铁,调pH除去铝离子,最后加碳酸钠形成碳酸镁,再通过过滤、洗涤、在50℃下干燥,得到Mg CO3·3H2O。
(1) ①MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O H1 = -50.4kJ·mol-1
②Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+ H2O(l) H2 =-225.4kJ·mol-1
②-2×①:Mg2SiO4(s)+2CO2(g)+H2O(l)=2MgCO3(s)+H2SiO3(s) △H=H2-2×H1=(-225.4kJ·mol-1)-2×(-50.4kJ·mol-1)= -124.6kJmol-1,该反应能正向进行的原因是该反应放热(或△H <0)有利于正向进行,平衡常数K=![]() ,故答案为:Mg2SiO4(s)+2CO2(g)+H2O(l)= 2MgCO3(s)+H2SiO3(s) △H=-124.6kJmol-1;该反应放热(或△H <0)有利于正向进行;K=
,故答案为:Mg2SiO4(s)+2CO2(g)+H2O(l)= 2MgCO3(s)+H2SiO3(s) △H=-124.6kJmol-1;该反应放热(或△H <0)有利于正向进行;K=![]() ;
;
(2) ①萃取是为了得到FeA3(有机层):
A.适当提高萃取剂的浓度,可以提高萃取效率,A正确;
B.提高溶液酸度,不利于FeA3(有机层)的生成,B错误;
C.多次萃取可以尽可能的得到FeA3,C正确;
D.有机层在上层,上层液体从上口倒出,D错误;
综上所述,AC正确,故答案为:AC;
②由Fe2(SO4)3(水层)+6HA(有机层)=2FeA3(有机层)+3H2SO4(水层)可知,加硫酸可使平衡逆向移动,使Fe3+进入水层,故答案为:促进萃取平衡逆向移动,使Fe3+进入水层;
(3)①滴加氨水是为了使铝离子沉淀而除去,将铝离子沉淀除去,pH至少为5.0,镁离子不能沉淀,否则会降低产率,pH需小于8.5,故答案为:5.0≤ pH <8.5;
②加Na2CO3溶液的目的是为了和Mg2+反应生成MgCO3沉淀,若Na2CO3过量,则上层清液中不含有Mg2+,可继续向上层清液中滴加Na2CO3溶液 ,若无沉淀生成,证明Na2CO3过量,故答案为:向上层清液中继续滴加Na2CO3溶液 ,若无沉淀生成,证明Na2CO3过量(其他答案合理即可);
(4)从反萃取平衡:Fe2(SO4)3(水层)+6HA(有机层)=2FeA3(有机层)+3H2SO4(水层)可知,硫酸太多不利于Fe3+萃取,同时再加氨水调pH除Al3+时将消耗更多的氨水,故答案为:不利于Fe3+萃取,避免制备MgCO3时消耗更多的氨水。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各选项对应关系错误的是
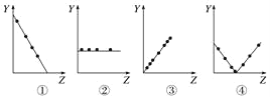
A.图①可以表示F-、Na+、Mg2+、Al3+四种半径的大小关系
B.图②可以表示ⅡA族元素原子的最外层电子数
C.图③可以表示第三周期各主族元素的最高化合价
D.图④可以表示第三周期中各主族元素的最高化合价与最低化合价之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
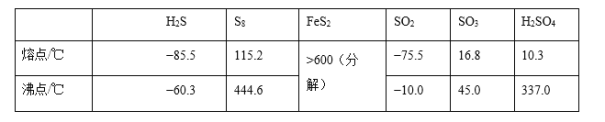
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____。
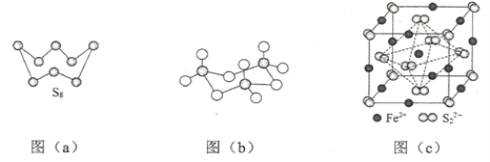
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有_____种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为_____。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____g·cm3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____nm。1molFeS2晶体中含有阴阳离子总数为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1 +ΔH2-3ΔH3)
(ΔH1 +ΔH2-3ΔH3)
B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1-ΔH2+3ΔH3)
(ΔH1-ΔH2+3ΔH3)
D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的原子结构如下表:
元素 编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素名称:________,元素Y的最简单氢化物的结构式为___________;
(2)Z元素原子的质量数为________;
(3)X和Z两种元素的简单离子,离子半径大的是________(填离子符号),X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为_____________;
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为_________________,若反应过程中转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为__________;
(5)写出Z2O2的电子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为7NA
B. pH=1的H3PO4溶液中,含有0.1NA个H+
C. 0.1mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D. 1L 0.1mol·L-1的NH4Cl溶液中含有NH4+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙三酸是一种有机酸,用H3A表示。25℃时,向1molL-1的H3A溶波中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列相关说法错误的是( )
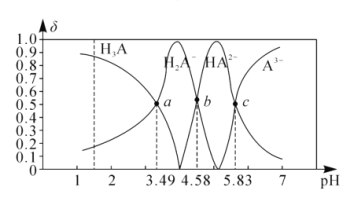
A.a点溶液中:c(H2A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,H3A的第二步电离平衡常数的数量级为10-5
C.b点溶液中:c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
D.当该溶液中c(HA2-)=c(A3-)时,溶液中水电离出的c(H+)>10-7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com