
【题目】镓是一种低熔点高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业;镓(Ga)与铝位于同一主族,金属镓的熔点是29.8℃,沸点是2403℃。
(1)工业上利用Ga(l)与NH3(g)在1000℃高温下合成半导体固体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.3 kJ热量。写出该反应的热化学方程式__________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
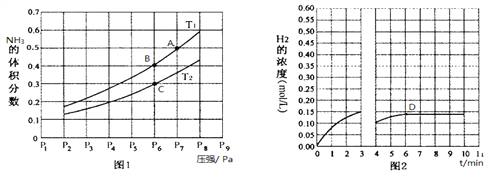
① 图1中A点和C点化学平衡常数的大小关系是:KA_____KC,(填“<”、“=”或“>”),理由是__________________________________________________。
② 该反应在T1和P6条件下至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4 min的浓度变化未表示出来),则改变的条件为__________(仅改变温度或压强中的一种)。
(3)若用压强平衡常数Kp表示,此时B点对应的Kp=__________(用含P6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(4)电解精炼法提纯镓的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质。在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________。
②阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,写出GaO2-在阴极放电的电极反应式是_____________。
【答案】 2Ga(l)+2NH3(g)=2GaN(s)+3H2(g) ΔH=-30.9 kJ·mol-1 < 由第1问可知该反应为放热反应,其他条件一定时,温度升高, 平衡逆向移动,此时NH3的体积分数越大而K值减小 减小压强 ![]() Fe、Cu GaO2- + 3e- + 2H2O = Ga+4OH-
Fe、Cu GaO2- + 3e- + 2H2O = Ga+4OH-
【解析】(1)反应的方程式为2Ga(s)+2NH3(g)2GaN(s)+3H2(g),生成3mol H2时放出30.9kJ的热量,可知热化学方程式为2Ga(s)+2NH3(g)2GaN(s)+3H2(g)△H=-30.9kJ/mol,故答案为:2Ga(s)+2NH3(g)2GaN(s)+3H2(g)△H=-30.9kJ/mol;
(2)①2Ga(s)+2NH3(g)2GaN(s)+3H2(g)△H=-30.9kJ/mol,为放热反应,对于放热反应而言,温度升高,平衡逆向移动,K减小,A点平衡常数小于C点平衡常数,故答案为:<;对于放热反应而言,其他条件一定时,温度升高, 平衡逆向移动,此时NH3的体积分数越大而K值减小;
②结合图示,改变的外界条件是降低压强,气体的体积增大,氢气的浓度减小,平衡向气体体积增大的方向进行,随后,氢气的浓度又逐渐增大,但会小于原平衡的浓度,故答案为:减小压强;
(3)2Ga(s)+2NH3(g)2GaN(s)+3H2(g),用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)①离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,则金属还原性顺序为Zn>Ge>Fe>Cu,则阳极上Zn、Ge失电子进入电解质溶液,Fe、Cu以金属单质形成阳极泥,则阳极泥成分是Fe、Cu,故答案为:Fe和Cu;
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,该反应的离子方程式为Ga3++4OH-=GaO2-+2H2O;阴极上GaO2-得电子发生还原反应生成Ga,电极反应式为GaO2-+3e-+2H2O=Ga+4OH-;故答案为:GaO2-+3e-+2H2O=Ga+4OH-。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地煤制乙醇的过程表示如下。
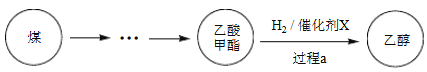
(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

① 气体A是_______。
② 实验室用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用_______。
③ NaClO溶液吸收气体A的离子方程式是_______。
(2)过程a包括以下3个主要反应:
Ⅰ.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1
C2H5OH(g)+CH3OH(g) ΔH1
Ⅱ.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5 (g)+CH3OH(g) ΔH2
CH3COOC2H5 (g)+CH3OH(g) ΔH2
Ⅲ.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) ΔH3
CH3CHO(g)+CH3OH(g) ΔH3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇选择性= ![]() )如下图所示。
)如下图所示。
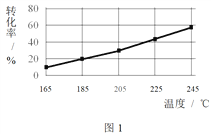
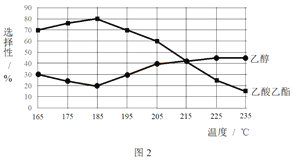
① 已知:ΔH1 < 0。随温度降低,反应Ⅰ化学平衡常数的变化趋势是_______。
② 下列说法不合理的是________。
A.温度可影响反应的选择性
B.225℃~235℃,反应Ⅰ处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③ 为防止“反应Ⅲ”发生,反应温度应控制的范围是_______。
④ 在185℃下,CH3COOCH3起始物质的量为5 mol,生成乙醇的物质的量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化硫通入到氯化钡溶液中未见到明显现象,把上述溶液分为两份,其中一份a加入NaOH溶液,另一份b中通入Cl2 , 均有白色沉淀产生,其中a中沉淀的化学式为 , b中沉淀的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行氢氧化铁胶体的制备实验。
甲同学:向1 mol·L-1的氯化铁溶液中加少量氢氧化钠溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是____________,若丙同学实验中不停止加热,会看到___________。
(2)氢氧化铁胶体制备的化学方程式为_______________________________;
(3)证明有氢氧化铁胶体生成利用的胶体性质是_______,提纯所制氢氧化铁胶体常用的方法是________。
(4)利用氢氧化铁胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明氢氧化铁胶体微粒带__________(填“正”或“负”)电荷;
②若向其中加入饱和硫酸钠溶液,产生的现象是________________________;
③若向其中逐滴加入稀盐酸,产生的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往FeCl3和BaCl2的混合溶液中通入SO2 , 溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )
A.该实验表明FeCl3有还原性
B.白色沉淀为BaSO3
C.该实验表明SO2有漂白性
D.反应后溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH![]() 、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
(1)该植物培养液中,NH![]() 的物质的量浓度为__________mol·L-1;
的物质的量浓度为__________mol·L-1;
(2)该研究小组配制该植物培养液时,还须用到的玻璃实验仪器有__________、__________;
(3)甲同学用NH4Cl、(NH4)2SO4和K2SO4三种物质进行配制,则需硫酸铵的质量为__________g;
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是__________。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,容量瓶中还有少量的水
c.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
e.摇匀后发现液面低于容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH3CH=CH2)与溴水反应时,对反应产物的推测正确的是
A.CH2BrCH2CH2BrB.CH3CHBr2CH3
C.CH3CH2CHBrD.CH3CHBrCH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com