
【题目】下列现象或事实可用同一原理解释的是( )
A.SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.不能用pH试纸测定浓硫酸和新制氯水的pH
D.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
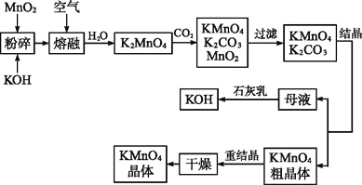
⑴ KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列 物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
⑵ 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式: 。
⑶ 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式: 。
⑷ 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是 。
⑸ 上述流程中可以循环使用的物质有石灰、CO2、 和 (写化学式)。
⑹ 若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得 mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】内锌矿的主要成分为ZnS,含有杂质PbS、CuS、FeS、SiO2等,以闪锌矿制备氯化锌的流程如图所示。
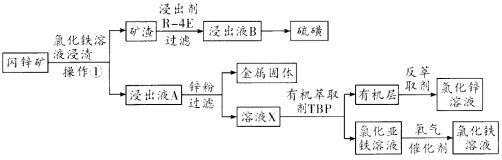
请回答下列问题:
(1)配制氯化铁浸渍液时要求pH为0.8~1之间,pH太高则 ,pH太低,浸渍矿石会产生有害气体 ,操作①是 。由氯化锌溶液制备氯化锌晶体的方法是 。
(2)高沸点溶剂R—4E几乎不溶于水,120℃时硫在R—4E里的溶解度为365g,室温时溶解度为35.9g,从浸出液B提取硫的方法是 。硫是工业制备硫酸的原料,现有1吨矿石,硫的总含量为24%,最多制备浓度98%的硫酸 吨。
(3)氯化铁与硫化锌发生反应:![]() ,则氯化铁与FeS反应的方程式为 。
,则氯化铁与FeS反应的方程式为 。
(4)溶液X的成分的化学式为 ,该流程中循环使用的物质是 。
(5)由氯化亚铁溶液制备氯化铁溶液,可以用![]() 、
、![]() ,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往200mL FeC13溶液中,通入0.672L标准状况下的H2S气体,气体完全被吸收,再加入过量的铁粉产生氢气,反应停止后,测得溶液中含有0.15 mol金属阳离子,求:
(1) FeC13溶液与H2S反应的离子方程式为__________________;
(2)加入过量铁粉充分反应后产生氢气在标准状况下的体积?
(3)原FeC13溶液的浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用金属活性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A.2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
B.Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
C.Fe+CuSO4 ===FeSO4+Cu
D.2NaCl(水溶液)![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
A.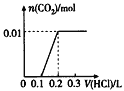 B.
B.
C.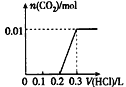 D.
D.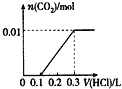
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
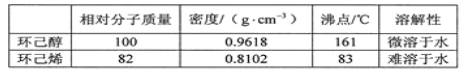
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 。
(4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.蒸馏烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是 (填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-220kJ/mol,H-H、O=O和O-H键的键能分别为436、496和462kJmol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵广泛应用与工农生产中,其生产流程图如下,回答下列问题:
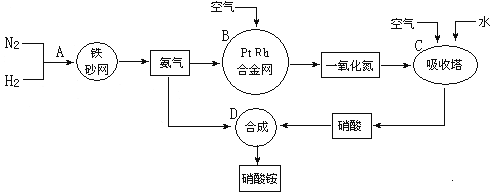
(1)在上述工业制硝酸的生产中,B设备的名称是 ,在反应中的氧化产物是 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(3)科学家以氨(NH3)为燃料开发新型的燃料电池。电池中填充可传导O2—离子的 MnO3固体电解质,电池总反应为:4NH3+3O2=2N2+6H2O。负极的电极反应式为 。
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量约占总耗NH3质量(不考虑其它损耗)的 %。(取两位有效数字)
(5)硝酸铵是一种常用的氮肥,在使用该化肥时避免与碱性肥料一起使用,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com