
我国某大城市今年夏季多次降下酸雨.据环保部门测定,该城市整个夏季酸雨的pH平均为3.2.在这种环境中的铁制品极易被腐蚀.对此条件下铁的腐蚀的叙述不正确的是( )
|
| A. | 此腐蚀过程有化学腐蚀也有电化学腐蚀 |
|
| B. | 发生电化学腐蚀时的正极反应为 2H2O+O2+4e﹣═4OH﹣ |
|
| C. | 在化学腐蚀过程中有氢气产生 |
|
| D. | 发生电化学腐蚀时的负极反应为Fe﹣2e﹣═Fe2+ |
| 金属的电化学腐蚀与防护. | |
| 专题: | 电化学专题. |
| 分析: | 酸雨pH=3.5,所以酸雨中含有大量氢离子;铁制品中含有铁和碳,具备了原电池的构成条件,所以构成了原电池;铁作负极,铁失去电子生成二价铁离子,碳作正极,溶液中的氢离子得电子生成氢气. |
| 解答: | 解:A、金属铁的腐蚀中,金属铁可以和酸中的氢离子直接发生化学腐蚀,铁制品中含有铁和碳,再加之电解质环境,具备了原电池的构成条件,所以构成了原电池,会发生电化学腐蚀,故A正确; B、发生电化学腐蚀时,碳作正极,溶液中的氢离子得电子生成氢气,2H++2e﹣=H2↑,故B错误; C、发生电化学腐蚀时,碳作正极,发生反应:2H++2e﹣=H2↑,有氢气产生,故C正确; D、发生电化学腐蚀时的负极是金属铁,电极反应式为:Fe﹣2e﹣═Fe2+,故D正确. 故选B. |
| 点评: | 本题考查了金属的腐蚀与防护,难度不大,能运用化学知识解释生产、生活现象,学以致用. |


科目:高中化学 来源: 题型:
某恒温恒容的容器中,建立如下平衡:2NO2(g) N2O4(g),在相同条件下, 若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时( )
N2O4(g),在相同条件下, 若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时( )
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s)  CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:
CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=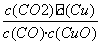
B.反应③的平衡常数K=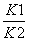
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应
D.对于反应③,恒温恒容下,增大压强,H2浓度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.溶度积大的化合物溶解度肯定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl为弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸。
(1)当其物质的量浓度相同时,[H+]由大到小的顺序是______________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH能力的顺序是____________。
(3)当其[H+]相同时,物质的量浓度由大到小的顺序为______________。
(4)当其[H+]相同、体积相同时,分别加入足量锌,相同状况下产生气体的体积由大到小的顺序为_________________________________________________________________。
(5)当[H+]相同、体积相同时,同时加入锌,若产生相同体积的H2(相同状况),则开始时的反应速率________,反应所需时间__________。
(6)将[H+]相同的三种酸均稀释10倍后,[H+]由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的说法正确的是( )
|
| A. | 中和滴定时,用待测溶液润洗锥形瓶 |
|
| B. | 使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小 |
|
| C. | 用酸式滴定管量取12.00 mL高锰酸钾溶液 |
|
| D. | 在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙二酸俗称草酸,为二元酸(结构简式为HOOC﹣COOH,可简写为H2C2O4).25℃时,草酸的电离平衡常数K1=5.0×10﹣2,K2=5.4×10﹣5;碳酸的电离平衡常数K1=4.5×10﹣7,K2=4.7×10﹣11.草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9.回答下列问题:
(1)写出水溶液中草酸的电离方程式: .
(2)25℃,物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH (填“大”“小”或“相等”).
(3)常温下将0.2mol/L的KOH溶液10mL与0.2mol/L的草酸溶液10mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序: .
(4)25℃时向20mL碳酸钙的饱和溶液中逐滴加入1.0×10﹣3 mol/L的草酸钾溶液20mL,能否产生沉淀? 否 (填“能”或“否”).
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式: ; .
查看答案和解析>>
科目:高中化学 来源: 题型:
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示。下列叙述中正确的是
( )
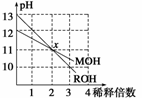
A.MOH和ROH都是强碱
B.稀释前,[ROH]=10[MOH]
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
D.在x点,[M+]=[R+]
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,分别将四块形状相同,质量为9 g的铁块同时投入下列四种溶液中,产生气体速率最快的是( )
A.200 mL 2 mol·L-1HCl
B.500 mL 2 mol·L-1H2SO4
C.100 mL 3 mol·L-1HCl
D.500 mL 18.4 mol·L-1H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com