

分析 银铜合金在空气中熔炼,渣料中含有氧化铜和少量银,加入稀硫酸,过滤后得到硫酸铜溶液,在硫酸铜溶液中加入硫酸铝和稀氢氧化钠溶液,煮沸、过滤得到Al(OH)3和CuO,煅烧可得到CuAlO2,滤渣A含有Ag,粗银电解时,粗银为阳极,在阴极上得到银,可得到提纯的目的,
(1)在硫酸铜溶液中加入硫酸铝和稀氢氧化钠溶液,发生CuSO4+2NaOH=Cu(OH)2↓+Na2SO4; Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4; 100度煮沸时发生Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,Al(OH)3不分解,氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐;
(2)固体B为Al(OH)3和CuO,煅烧生成CuAlO2,结合质量守恒定律解答;
(6)m(Cu)=64%×5.0kg=3.2Kg=3200g,n(Cu)=m÷M=3200g÷64g/mol=50mol,由于在CuAlO2中Cu、Al个数比为1:1,结合质量守恒计算.
解答 解:银铜合金在空气中熔炼,渣料中含有氧化铜和少量银,加入稀硫酸,过滤后得到硫酸铜溶液,在硫酸铜溶液中加入硫酸铝和稀氢氧化钠溶液,煮沸、过滤得到Al(OH)3和CuO,煅烧可得到CuAlO2,滤渣A含有Ag,粗银电解时,粗银为阳极,在阴极上得到银,可得到提纯的目的,
(1)在硫酸铜溶液中加入硫酸铝和稀氢氧化钠溶液,煮沸,发生的反应为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4; Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4; 100度煮沸时氢氧化铜发生分解反应:Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,Al(OH)3不分解.所以得到的固体混合物B是Al(OH)3和CuO.氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐,NaOH过量引起的反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O;
(2)固体B为Al(OH)3和CuO,煅烧生成CuAlO2,反应的化学方程式为4CuO+4Al(OH)3$\frac{\underline{\;高温\;}}{\;}$4CuAlO2+6H2O+O2↑,
故答案为:4CuO+4Al(OH)3$\frac{\underline{\;高温\;}}{\;}$4CuAlO2+6H2O+O2↑;
(6)m(Cu)=64%×5.0kg=3.2Kg=3200g,
n(Cu)=m÷M=3200g÷64g/mol=50mol,
由于在CuAlO2中Cu、Al个数比为1:1,
所以根据原子守恒可得:n[Al2(SO4)3]=$\frac{1}{2}$n(Al)=$\frac{1}{2}$ n(Cu)=25mol,
n=$\frac{25mol}{1mol/L}$=25L,
故答案为:25.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析、计算和实验能力的考查,注意把握物质的性质以及实验流程所给信息,结合质量守恒定律完成该题,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1mol化合物Ⅰ能与4molH2发生完全加成反应
1mol化合物Ⅰ能与4molH2发生完全加成反应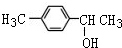 或
或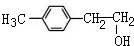 (写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.
(写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.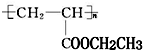 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中用铜片与稀HNO3反应制备NO2 | |
| B. | 常温下可以用铝制容器来盛装浓HNO3 | |
| C. | 实验室中用浓H2SO4干燥NH3 | |
| D. | 加热时,浓H2SO4不能将木炭氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作正确 | |
| C. | 滴定前无气泡,滴定终了有气泡 | |
| D. | 配制标准溶液的Na0H中混有Na20杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取在空气中久置的碳酸钠晶体143.0g | |
| B. | 定容时,仰视观察刻度线 | |
| C. | 转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤 | |
| D. | 定容后,将容量瓶震荡摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “天宫”一号中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 氢氧化铁溶胶、雾、食盐水均能观察到丁达尔效应 | |
| C. | 盐酸、氢氧化铁胶体、汽油、橡胶均为混合物 | |
| D. | 生成盐和水的反应不一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
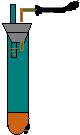 如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com