

分析 (1)由图可知,为固体与液体混合制备氨气,且不需要加热;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行;液体石蜡鼓泡瓶可观察到气体的流速;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,得到干燥产品时应防止分解和氧化;
③浓硫酸可吸收氨气、水;
(3)用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g,n(碳酸钙)=$\frac{1.500g}{100g/mol}$=0.015mol,结合元素守恒、质量守恒计算.
解答 解:(1)由图可知,为固体与液体混合制备氨气,且不需要加热,则把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热使浓氨水分解生成氨气,
故答案为:浓氨水与生石灰或氢氧化钠固体等;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,
故答案为:降低温度,促平衡正向移动,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);通过观察气泡,调节NH3与CO2通入比例;
②制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,为防止产品分解和被氧化,采用真空40℃以下烘干,
故答案为:过滤;c;
③浓硫酸起到吸收多余的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解,故答案为:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g,碳酸钙物质的量为$\frac{1.500g}{100g/mol}$=0.015mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,
由碳元素守恒及质量守恒可知
$\left\{\begin{array}{l}{x+y=0.015}\\{78x+79y=1.1730}\end{array}\right.$,
解得x=0.012mol、y=0.003mol,
则样品中氨基甲酸铵的物质的量分数为$\frac{0.012mol}{0.012mol+0.03mol}$×100%=80%,
故答案为:80%.
点评 本题考查物质的制备实验,为高频考点,把握气体的制备原理、平衡移动原理、混合物分离提纯等为解答的关键,(3)中注意守恒法应用,侧重分析与实验、计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
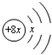 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )| A. | 对应氢化物的沸点:R>Z>X | |
| B. | Y、Z形成的化合物中只有离子键 | |
| C. | 离子半径:X>Z>Y | |
| D. | Z与X、Y与R形成化合物的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl→CH3CH2Cl | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 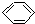 +HO-NO2 $→_{60℃}^{浓硫酸}$ +HO-NO2 $→_{60℃}^{浓硫酸}$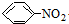 +H2O +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH+H2O→CH3CHO | |
| B. | C2H5Br+H2O$\frac{\underline{\;NaOH\;}}{△}$C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$\frac{\underline{\;催化剂\;}}{△}$CH3COOH+CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 1.0 | 0 | 1.0 |
| B | 0 | 0 | 2.0 |
| C | 0.2 | 0.1 | 1.8 |
| D | 1.5 | 0.75 | 1.0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯分子的电子式: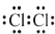 | B. | 氯离子(Cl-)的结构示意图: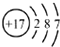 | ||
| C. | 中子数为20的氯原子: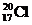 | D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com