
| A. | 甲的体积比乙的体积大 | B. | 甲的分子数比乙的分子致少 | ||
| C. | 甲的压强比乙的压强大 | D. | 甲的摩尔体积比乙的华尔体积大 |
分析 相同温度下,在两个密闭容器中,分别充有等质量、等密度的H2、O2两种气体,根据ρ=$\frac{m}{V}$可知气体的体积相等,根据Vm=$\frac{V}{n}$比较气体摩尔体积大小,根据n=$\frac{m}{M}$判断气体的物质的量,气体物质的量越大,气体分子数越多;两容器的容积相同时气体分子数越多,压强越大,据此进行解答.
解答 解:A.根据V=$\frac{m}{ρ}$可知,两个容器的体积相等,故A错误;
B.根据N=$\frac{m}{M}$NA可知,质量相等的O2、H2含有分子数与其摩尔质量成反比,H2的摩尔质量较小,则甲的分子数比乙的分子数少,故B正确;
C.乙容器中含有气体分子数较多,而两个容器的体积相等,则相同温度时甲的压强比乙的压强小,故C错误;
D.两个容器体积相等,质量相等时氢气的物质的量较大,根据Vm=$\frac{V}{n}$可知,容器甲的摩尔体积较小,故D错误;
故选B.
点评 本题考查阿伏伽德罗定律及其讨论,题目难度不大,明确阿伏伽德罗定律及讨论内容为解答关键,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 通入标准状况下的HCl气体11.2L | |
| B. | 加入10mol/L的盐酸0.1VL,再稀释至1.5L | |
| C. | 将溶液加热浓缩到0.5VL | |
| D. | 加入2mol/L的盐酸VL混合均匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3具有还原性 | B. | N2只具有还原性 | C. | N2只具有氧化性 | D. | HNO3具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
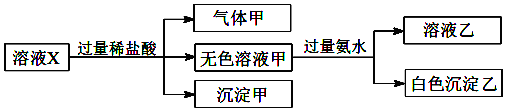
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸钙的混合物 | |
| C. | CO32-和SO42-一定不存在于溶液X中 | |
| D. | Na+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据事实,写出下列反应的热化学方程式.
依据事实,写出下列反应的热化学方程式.| O═O | H-H | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com