
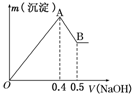
 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 6:1 |
分析 依据图中关系可知,加入氢氧化钠溶液0.4体积时,发生反应AlCl3~Al(OH)3↓、MgSO4~Mg(OH)2↓,则0.4V~0.5体积时NaOH发生了NaOH与氢氧化铝的反应,由铝原子守恒可判断原溶液中的铝离子,即得出氯离子的量,依据0~0.4V氢氧化钠溶液时发生反应AlCl3~Al(OH)3↓、MgSO4~Mg(OH)2↓,求出Mg2+的量,进而得到SO42-的物质的量,据此解答.
解答 解:第一条上升的直线是表示AlCl3和MgSO4一起产生沉淀,第二条下降的直线表示Al(OH)3沉淀溶解,设氢氧化钠溶液的浓度为c,根据Al(OH)3+OH-═AlO2-+2H2O,第二条直线可知加入0.1V体积的NaOH将氢氧化铝完全溶解,可知AlCl3是0.1cVmol,则氯离子的物质的量为0.3cVmol,再根据Al3++3OH-═Al(OH)3↓,由这些氯化铝完全沉淀消耗氢氧化钠0.3V体积;
再根据第一条直线可知,0.4V-0.3V=0.1V体积的氢氧化钠将镁离子全部沉淀,而Mg2++2OH-═Mg(OH)2↓,所以MgSO4为0.05cVmol,所以硫酸根离子的物质的量为0.05cVmol,
所以原溶液中Cl-与SO42-的物质的量之比为0.3cVmol:0.05cVmol=6:1,
故选:D.
点评 本题考查了有关离子方程式的计算,明确图中各段发生的离子反应是解题关键,注意氢氧化铝的两性,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| B. | 乙醛和乙酸都含有碳氧双键,二者都能发生加成反应 | |
| C. | 苯可以发生加成反应,但苯中不含有碳碳双键 | |
| D. | 乙醇和苯酚都含有羟基都能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
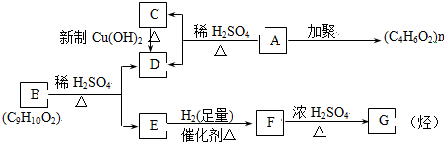
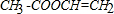 ,B:
,B: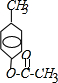 ;
;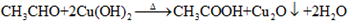 ,
,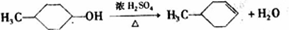 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
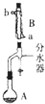 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可根据同周期元素的第一电离能变化规律,推出Al的第一电离能比Mg大 | |
| B. | 结构和组成相似的分子晶体,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据溶解度小的沉淀易向溶解度更小的沉淀转化的规律,推出在ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 芳香烃属于碳氢化合物 | ||
| C. | 乙炔是含碳量最高的碳氢化合物 | D. | 溴苯属于碳氢化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com