
| A、分解反应一定是氧化还原反应 |
| B、非金属单质在氧化还原反应中一定作氧化剂 |
| C、氧化剂具有氧化性,还原剂具有还原性 |
| D、氧化剂在氧化还原反应中被氧化 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20 mL,3mol.L-1 |
| B、20 mL,2mol.L-1 |
| C、10 mL,4mol.L-1 |
| D、10 mL,2mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
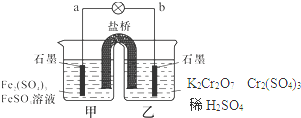
| A、甲烧杯的溶液中发生还原反应 |
| B、乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-=Cr2O72-+14H+ |
| C、外电路的电流方向是从b到a |
| D、电池工作时,盐桥中的SO42- 移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
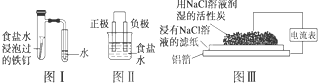
| A、按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B、图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-═Cl2↑ |
| D、图Ⅲ装置的总反应为4Al+3O2+6H2O═4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该混盐具有和漂白粉相似的化学性质 |
| B、该混盐的水溶液呈中性 |
| C、该混盐与硫酸反应产生1 mol Cl2时转移2 mol电子 |
| D、该混盐中氯元素的化合价为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:锂<钠<钾<铷<铯 |
| B、由于HCl的分子间作用力大于HI,故HCl比HI稳定 |
| C、等质量的金刚石和石墨晶体所含碳碳键的数目相等 |
D、已知AB的离子晶体结构如上图所示,则每个A+周围距离最近且等距的B-有8个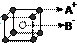 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com