
| A. | 氯化钡溶液和盐酸 | B. | 硝酸银溶液和硝酸 | ||
| C. | 氯化钡溶液和硝酸银溶液 | D. | 硝酸钡溶液和硝酸银溶液 |
分析 检验Na2SO4和NaCl混合物中含有NaCl,先加硝酸钡排除硫酸根离子的干扰,再加硝酸银观察是否有白色沉淀,若生成白色沉淀,则含NaCl,反之不含,以此来解答.
解答 解:A.加氯化钡、盐酸均引入氯离子,不能检验NaCl,故A不选;
B.加硝酸银,二者均反应生成白色沉淀,不能检验,故B不选;
C.加氯化钡引入氯离子,不能检验NaCl,故C不选;
D.先加硝酸钡排除硫酸根离子的干扰,再加硝酸银观察是否有白色沉淀,若生成白色沉淀,则含NaCl,故D选;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意检验时排除干扰,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
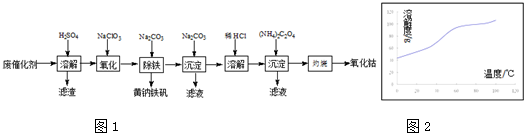
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制盐酸溶液,用量筒取盐酸时俯视刻度线 | |
| B. | 配制盐酸溶液定容时,仰视容量瓶 | |
| C. | 称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘 | |
| D. | 配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
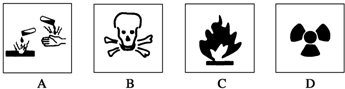
| A. | 浓硫酸----A图标 | B. | 酒精----B图标 | ||
| C. | 汽油----C图标 | D. | 放射性物品----D图标 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
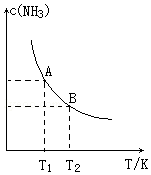 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液都是均一、稳定的分散系,静置不易产生沉淀 | |
| B. | 胶体与纳米级微粒在直径上具有相同数量级 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 向Fe(OH)3胶体中逐滴加入稀硫酸无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH4+的质量为18g | |
| B. | SO2的摩尔质量为64g•mol-1 | |
| C. | 铝原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个水分子的质量约等于$\frac{18}{6.02×1{0}^{23}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠比碳酸钠热稳定强 | |
| B. | Na2O2可用作供氧剂 | |
| C. | K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 | |
| D. | 打磨过的铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com