
下列反应中,氯元素被氧化的是
A.2KClO3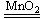 2KCl+3O2↑ B.2P+5Cl2
2KCl+3O2↑ B.2P+5Cl2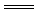 2PCl5
2PCl5
C.MnO2+4HCl(浓)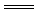 MnCl2十2H2O+Cl2↑ D.H2+Cl2
MnCl2十2H2O+Cl2↑ D.H2+Cl2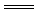 2HCl
2HCl
科目:高中化学 来源: 题型:
下列电离或水解方程式正确的是
A.Na2SO3的水解:SO32-+ 2H2O H2SO3 + 2OH-
H2SO3 + 2OH-
B.NaHCO3的电离:NaHCO3  Na + + H+ + CO32-
Na + + H+ + CO32-
C.KHS的电离:HS- + H2O  H3O+ + S2-
H3O+ + S2-
D.NaClO溶液与FeCl2溶液混合:2ClO- + Fe2+ + 2H2O = 2HClO + Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯
化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪个氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则
溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含
所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实
验现象,证明了乙同学的观点是正确的。
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到得现象。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生
的离子反应方程式为 。
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
水作为还原剂的反应是 ( )
A. 2Na+2H2O==2NaOH+H2↑ B. SO3+H2O==H2SO4 C. 2F2+2H2O=4HF+O2 D. 2H2+O2 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+、MnO4-→Mn2+、Cl2→2Cl-、HNO2→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4- C.Cl2 D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.室温下饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M),p(CO )=-lg c(CO
)=-lg c(CO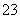 )。下列说法正确的是 ( )
)。下列说法正确的是 ( )
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+) <c(CO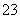 )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO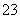 )
)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO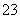 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
依据事实,写出下列反应的热化学方程式。
⑴.在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。 放出571.6kJ的热量,
表示H2燃烧的热化学方程式为_____ _____ ____。
⑵. 在25℃、101kPa下,1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ。 则表示甲醇
燃烧热的热化学方程式为__________________________________________ ______
⑶.已知:已知:C(s)+O2(g)=CO2(g) ΔH=-437.3 kJ·mol一1
H2(g)+  O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1
CO(g)+  O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com