
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
科目:高中化学 来源: 题型:推断题
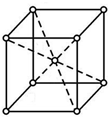 X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1.
X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1. ;W元素的名称为镍.
;W元素的名称为镍.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
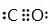 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.
,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些染料褪色 | ||
| C. | 二氧化硫使品红溶液褪色 | D. | 活性炭使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米碳管是一种无机化合物 | |
| B. | 0.12g纳米碳管中含有6.02×l022个碳原子 | |
| C. | 纳米碳管与石墨互为同位素 | |
| D. | 纳米碳管中碳原子间以共价键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种元素的原子量为m | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | (m+n)可写在该元素符号的左上角 | |
| D. | 核内中子的总质量小于质子的总质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com