
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol |
B. CH4(g)+O2(g)= CH4(g)+O2(g)= CO2(g)+H2O(l) △H=-445kJ/mol CO2(g)+H2O(l) △H=-445kJ/mol |
C. CO2(g)+H2O(l)= CO2(g)+H2O(l)= CH4(g)+O2(g) △H= +445kJ/mol CH4(g)+O2(g) △H= +445kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-55.625kJ/mol |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
 与
与 反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是
反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是
A.该反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=+92kJ/mol 2NH3(g)ΔH=+92kJ/mol |
B. 曲线是加入催化剂时的能量变化曲线 曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热数值会减小 |
D.反应2NH3(g)  N2(g)+3H2(g) ΔH=+92kJ/mol N2(g)+3H2(g) ΔH=+92kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2 + O2 = 2H2O△H= -571.6KJ/mol |
| B.H2(g)+ 1/2O2(g)= H2O (l)△H= -142.9KJ/mol |
| C.H2(g)+ 1/2O2(g)= H2O (l)△H= -285.8KJ/mol |
| D.2H2(g)+ O2(g) = 2H2O (g)△H=" -571.6KJ/mol" |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KOH(aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-11.46kJ/mol |
| B.2KOH(s) + H2SO4(aq) = K2SO4(aq) + 2H2O(l);ΔH =-114.6kJ/mol |
| C.2KOH(aq) + H2SO4 =K2SO4(aq) + H2O(l);ΔH =+114.6kJ/mol |
| D.KOH (aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右: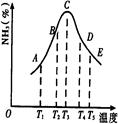
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2Q | B.0.1Q | C.5Q | D.10Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com