
| A. | 1molN2+3molH2 | B. | 2molNH3+1molHe | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
分析 反应2NH3?3H2+N2,在恒温恒容下,不同途径达到平衡后,容器内C(N2)不能维持0.9mol/L,说明与原平衡不是等效平衡,按化学计量数转化到方程式的左边,不能满足n(NH3)=2mol即可,据此进行分析.
解答 解:根据等效平衡,按化学计量数转化到方程式的左边,不满足n(NH3)=2mol,则达到平衡时,容器内C(N2)不能维持0.9mol/L.
A、1molN2+3molH2按化学计量数转化到方程式的左边,满足n(NH3)=2mol,属于等效平衡,故A错误;
B、2molNH3+1molHe与初始量多1molHe,因为固定的密闭容器,所以1molHe不影响平衡移动,则属于等效平衡,故B错误;
C、2molN2+3molH2按化学计量数转化到方程式的左边,满足n(NH3)=2mol,n(N2)=1mol,与初始初始加入物质不同,不是等效平衡,故C正确;
D、0.1molNH3+0.95molN2+2.85molH2,按化学计量数转化到方程式的左边,满足n(NH3)=2mol,属于等效平衡,故D错误;
故选C.
点评 本题考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨能在空气中燃烧,生成N2和水 | |
| B. | NO2溶于水生成HNO3,NO2属于酸性氧化物 | |
| C. | 所有的铵盐加热分解都能产生NH3 | |
| D. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12LSO3所含的原子数是0.2NA | |
| B. | 3.9gNa2O2吸收足量的CO2时转移电子数是0.05NA | |
| C. | 20g重水中含有中子数为8NA | |
| D. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
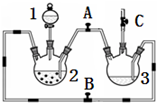 某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变,降温,平衡右移,逆反应速率增大 | |
| B. | 保持体积、温度不变,充入氦气后,正反应速率将增大 | |
| C. | 保持体积、温度不变,充入NH3气体,平衡向右移动 | |
| D. | 保持温度、压强不变,充入NH3气体,平衡混合气中NH3的体积分数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com