
| A. | KCl | B. | Na2S | C. | Na2O | D. | K2S |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径的大小顺序为:rw>rz>ry | |
| B. | 元素W的氧化物对应水化物的酸性比Y的强 | |
| C. | X与Y形成的晶体XaYa的熔点高硬度大,为可替代金刚石的材料 | |
| D. | X与W形成的化合物和Z与W形成的化合物的化学类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共有7个周期,16个族 | |
| B. | 形成化合物种类最多的元素在第2周期 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为锌、铜、硫酸铜溶液构成的原电池,请写出负极、以及电池总反应.
如图为锌、铜、硫酸铜溶液构成的原电池,请写出负极、以及电池总反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | NaCl的电子式为  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则 H2SO4 和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CH3与 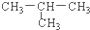 | B. | C3H8与C6H14 | ||
| C. | 乙烯和1,3-丁二烯 | D. | CH3CH2Cl 和CH2ClCH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通CO的一极是电池的正极 | |
| B. | 该电池工作过程中需不断补充CO和O2,CO2可循环利用 | |
| C. | 负极反应式为:O2+2CO2+4e-→2CO32- | |
| D. | 正极反应式为:2CO+2CO32-→4CO2+4e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com