
| A. | 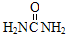 | B. | H2NCH2CH2NH2 | C. | (NH4)2CO3 | D. | Na2CO3 |
科目:高中化学 来源: 题型:选择题
| A. | a(A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a(B)=a′(B) | C. | a(A)<a′(A) a(B)<a′(B) | D. | a(A)=a′(A) a(B)>a′(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
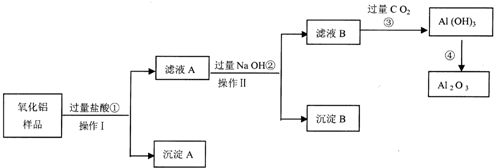
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)4]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| C. | 实验室用已知浓度的酯酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要大一点 | |
| D. | 自来水厂常用某些含铝或铁的化合物作净水剂,是由于它们具有杀菌作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
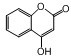 是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
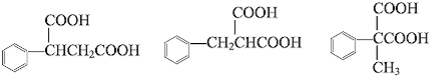 中的任意一种.
中的任意一种.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe3+易水解,它的水解产物之一能抑制的Fe2+水解 | |
| B. | Fe2+有较强的还原性,它能还原Fe3+ | |
| C. | Fe3+有较强的氧化性,它能氧化Fe2+ | |
| D. | Fe3+的水解是吸热反应,升温能促进它的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 热稳定性:H2S>H2O>HF | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:F2>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Z、W分别与Y形成的常见化合物均为碱性氧化物 | |
| B. | X和R形成的常见化合物中各原子都达到8电子稳定结构 | |
| C. | 离子半径的大小顺序为:Z+>W2+>Y2- | |
| D. | 含有Y、Z、R三种元素的化合物最多只有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com