
 常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )
常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )| A. | 从图象中可知H2A为强酸 | |
| B. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c( A2-)>c(OH-) | |
| C. | 当V(NaOH)=20 mL时混合溶液的pH值大于7 | |
| D. | 当V(NaOH)=40 mL时,升高温度,c(Na+)/c(A2-)减小 |
分析 A.H2A溶液中存在H2A分子,说明H2A部分电离;
B.根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A═NaHA+H2O,溶液主要为NaHA,溶液中c( A2-)大于c( H2A),以电离为主,溶液显酸性;
C.当V(NaOH)=20 mL时,溶液中c( A2-)大于c( H2A);
D.向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液40ml,反应后得到溶液为Na2A溶液,A2-离子水解溶液显碱性,加热促进水解.
解答 解:A.H2A溶液中存在H2A分子,说明H2A部分电离,所以H2A为弱酸,故A错误;
B.根据图象知,当V(NaOH)=20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶质主要为NaHA,HA-电离程度大于水解程度,溶液显酸性,水和HA-都电离出氢离子,只有HA-电离出A2-,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;
C.当V(NaOH)=20 mL时,溶液中c( A2-)大于c( H2A),HA-电离程度大于水解程度,溶液显酸性,即混合溶液的pH值小于7,故C错误;
D.向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液40ml,反应后得到溶液为Na2A溶液,A2-离子水解溶液显碱性,加热促进水解A2-离子浓度减小,钠离子浓度不变,则比值增大,故D错误.
故选B.
点评 本题考查酸碱混合溶液定性判断,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等,侧重于考查学生的分析能力和应用能力.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH-—14e -==2CO
-==2CO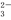 +12H2O、7H2O+7/2O2+14e-==14OH-,有关此电池的推断正确的是
+12H2O、7H2O+7/2O2+14e-==14OH-,有关此电池的推断正确的是
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO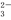 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
以NA代表阿伏加德罗常数,下列说法正确的是
A.在标准状况下,NA 个H2O 分子所占体积约为22.4L
B.0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
C.常温常压下, 2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA
D.0.5mol/L的NaCl溶液中Cl—的个数为是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2+2Br- | |
| C. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=I2+4Br-+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向20mL0.5mol•L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法,错误的是( )
向20mL0.5mol•L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法,错误的是( )| A. | 溶液pH:b>c>a | |
| B. | a点:c(H+)-c(OH-)=$\frac{1}{2}$[c(CH3COO-)-c(CH3COOH)] | |
| C. | a到b,溶液中可能存在:c(CH3COO-)=c(Na+) | |
| D. | b到c,溶液中可能存在:c(CH3COO-)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-11.46 kJ/mol | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-11.46 kJ/mol | |
| C. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol | |
| D. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 12种 | C. | 18种 | D. | 24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| B. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| C. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被腐蚀 | |
| D. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com